科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-15
来源:BioArt
在全球范围内,肾脏相关疾病的发病率日益增长。然而,过去半个世纪以来,针对晚期肾脏疾病(ESRD)的治疗方法并没有根本性的改善。肾脏移植和透析依然是治疗ESRD最常用的方法。近年来科学家使用人类多能干细胞(胚胎干细胞和诱导多能干细胞)培育出肾脏器官微模型(肾脏类器官),并以此作为平台研究肾脏发育和相关疾病的致病机理【1-3】。然而,不仅肾脏类器官,由人类多能干细胞分化得到的其他类型的类器官都面临一些共同的难题,比如缺少原器官所应有的某种特殊结构(特别是血管网络),不稳定的分化结果,缺少类器官内的细胞间通讯,成熟度不高以及功能不全【4-6】。
2019年7月11日,新加坡南洋理工大学李光前医学院夏云团队,联合Juan Carlos Izpisua Belmonte团队(美国Salk研究所)和Foo Jia Nee团队(新加坡南洋理工大学和新加坡A*STAR基因组研究所),在Cell Stem Cell发表题为Generation ofhuman-PSC derived kidney organoids with patterned nephron segments and a de novo vascular network 的研究论文。该课题组建立了一个高效且灵活的分化方法,将人多能干细胞分化为3D的肾脏类器官。这些肾脏类器官具有肾单位状的分段结构,并且有丰富的De novo血管网络。此方法通过动态调控WNT信号通路从而调节3D肾脏类器官中肾单位近端和远端结构的相应比例。并且,该研究发现内源性血管的分化和成熟依赖于足细胞分泌的血管内皮生长因子,并且血管内皮生长因子分泌量决定了血管网络的丰度。通过将该肾脏类器官移植到小鼠体内,这些肾脏类器官进一步成熟,并且呈现出具有大小选择性的初级过滤功能。

研究人员以此类肾脏类器官为模型,对常染色体隐性多囊肾病(ARPKD, autosomal recessive polycystic kidneydisease)进行了相关研究。以病人iPSC诱导生成肾脏类器官,在细胞内高水平cAMP刺激下会产生大量的管道囊肿。通过对致病基因PKHD1进行基因修复,或者用小分子化合物处理,可以有效地改善囊肿的产生。这些实验结果证明了该肾脏类器官可以作为潜在模型以疾病特异性的方式来评估药物效果。
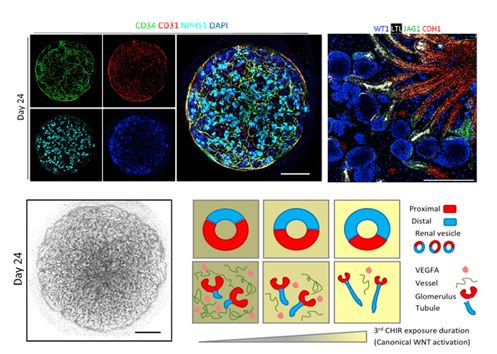
3D肾脏类器官及肾单位近端和远端结构调控模型
过去基于对模式生物的遗传学研究中,肾脏血管系统的起源问题一直悬而未决。该团队将肾脏类器官进行单细胞转录组测序(single-cell RNA-sequencing),揭示了人类肾脏发育过程中新的谱系关系。研究人员通过对肾脏分化过程第10,12,14天62506个单细胞转录组分析,结果发现肾单位祖细胞是肾脏血管的一个非常规来源。对Susana M. Chuva de SousaLopes组和Stefan Semrau组合作发表的单细胞测序结果【7】的重分析以及对人类孕中期肾脏样本的FACS分析也同样支持了这一观点。此外,对血管内皮细胞sub-cluster的单细胞分析发现此类肾脏类器官的血管内皮细胞已经形成了良好的遗传网络,并可以特异性生成不同的内皮亚型结构,即动脉和静脉。
该肾脏类器官模型的建立,使我们对肾脏的发育过程有了新的理解,也将极大的推动肾脏生理学和病理学的研究。
据悉,夏云课题组的Low Jian Hui, 李品与Foo Jia Nee课题组的Elaine Guo Yan Chew为本文共同第一作者。
原文链接:
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(19)30273-5
参考文献
1. MORIZANE, R., LAM,A. Q., FREEDMAN, B. S., KISHI, S., VALERIUS, M. T. & BONVENTRE, J. V. 2015.Nephron organoids derived from human pluripotent stem cells model kidneydevelopment and injury. Nat Biotechnol,33, 1193-200.
2. TAKASATO, M., ER, P. X., CHIU, H. S., MAIER, B., BAILLIE,G. J., FERGUSON, C., PARTON, R. G., WOLVETANG, E. J., ROOST, M. S., CHUVA DESOUSA LOPES, S. M. & LITTLE, M. H. 2015. Kidney organoids from human iPScells contain multiple lineages and model human nephrogenesis. Nature, 526, 564-8.
3. AGUCHI, A. &NISHINAKAMURA, R. 2017. Higher-Order Kidney Organogenesis from Pluripotent StemCells. Cell Stem Cell, 21, 730-746 e6.
4. CZERNIECKI, S. M.,CRUZ, N. M., HARDER, J. L., MENON, R., ANNIS, J., OTTO, E. A., GULIEVA, R. E.,ISLAS, L. V., KIM, Y. K., TRAN, L. M., MARTINS, T. J., PIPPIN, J. W., FU, H.,KRETZLER, M., SHANKLAND, S. J., HIMMELFARB, J., MOON, R. T., PARAGAS, N. &FREEDMAN, B. S. 2018. High-Throughput Screening Enhances Kidney OrganoidDifferentiation from Human Pluripotent Stem Cells and Enables AutomatedMultidimensional Phenotyping. Cell StemCell, 22, 929-940 e4.
5. PHIPSON, B., ER,P. X., COMBES, A. N., FORBES, T. A., HOWDEN, S. E., ZAPPIA, L., YEN, H. J.,LAWLOR, K. T., HALE, L. J., SUN, J., WOLVETANG, E., TAKASATO, M., OSHLACK, A.& LITTLE, M. H. 2019. Evaluation of variability in human kidney organoids. Nat Methods, 16, 79-87.
6. WU, H., UCHIMURA,K., DONNELLY, E. L., KIRITA, Y., MORRIS, S. A. & HUMPHREYS, B. D. 2018.Comparative Analysis and Refinement of Human PSC-Derived Kidney OrganoidDifferentiation with Single-Cell Transcriptomics. Cell Stem Cell, 23,869-881 e8.
7. HOCHANE, M., VAN DEN BERG, P. R., FAN, X.,BERENGER-CURRIAS, N., ADEGEEST, E., BIALECKA, M., NIEVEEN, M ., MENSCHAART, M.,CHUVA DE SOUSA LOPES, S. M. & SEMRAU, S. 2019. Single-cell transcriptomicsreveals gene expression dynamics of human fetal kidney development. PLoS Biol, 17, e3000152.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472547&idx=4&sn=4c3a6f292a59f6c4a827cedb955a8746&chksm=84e21757b3959e41e4062d35a6b16fb643a2c3dfb52d2ba7faad7cf9c7ab70c9a8d61d9665d0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人猪胚胎后世界首例人羊嵌合体诞生, 可培育人体器官
肾脏叩诊
肾脏超声检查
你的肾脏“超负荷”了吗?保护肾脏应注意饮食

【每日科技速递】远望7号船完成北斗“一箭双星”海上测控任务
世界肾脏日|预防肾脏病,我们能做什么?

中国生物医学工程学会人工器官分会2018年学术年会通知
中国药理学会肾脏药理专业委员会成立大会顺利召开



“手”到病除 攀登外科技术高峰 ——记第15届上海市科技精英王林辉

上海交大最新发现,除了肺部,心脏、肾脏等器官也易被新冠病毒感染