科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-25
来源:BioArt
线粒体ATP/ADP转运蛋白(Mitochondrial ADP/ATP carrier, AAC)是线粒体内膜上最主要的转运蛋白。AAC负责交换线粒体中ATP与胞质中ADP并控制细胞中ATP的产生【1】。除此之外,有一些研究表明AAC可能参与到了线粒体解偶联过程中,但是其中AAC的具体功能以及其发挥功能的具体分子机制还不得而知。
2019年1月,英国剑桥大学Edmund Kunji研究组在Cell发文The Molecular Mechanism of Transport by theMitochondrial ADP/ATP Carrier,对于AAC在ATP/ADP转运过程动态结构进行了解析(图1)。AAC蛋白面向线粒体基质方向运输ADP进入线粒体,此时AAC蛋白结构状态称为m-state(Matrix-open state);面向胞质方向将ATP运输进入胞质的状态称为c-state(Cytoplasmic-open state)。AAC在ATP/ADP转运过程中的存在六个可移动组件的动态构象变化,该文章对于大家进一步了解AAC的功能提供了重要的结构生物学基础。同时,该文章还提供了简单易懂的视频供大家学习。
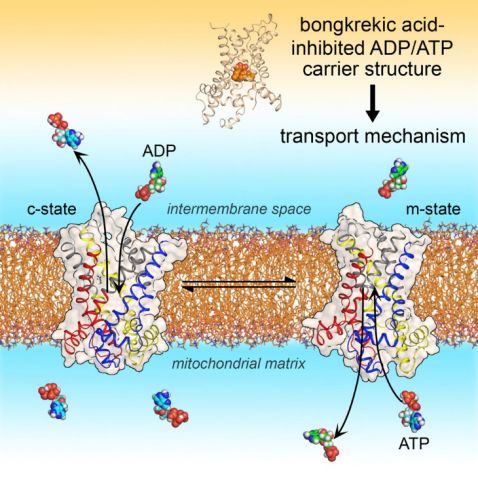
图1 ATP/ADP转运蛋白结构示意图【2,3】
虽然在ATP/ADP转运过程中的动态结构已经解析的非常清楚,但是AAC在生理状态下如何发挥功能的还不得而知。为了对该问题进行进一步地研究,2019年7月25日,来自加州大学旧金山分校的Yuriy Kirichok研究组在Nature发文H+ transport is an integral function of themitochondrial ADP/ATP carrier,对AAC在小鼠不同组织中参与ATP/ADP转运以及H+运输的机制进行探究,为理解生理条件下AAC的功能提供了重要的证据。

在人类中,AAC有四个亚型AAC1-AAC4,AAC4特异性表达在生殖细胞和多能干细胞之中【1】,而小鼠之中缺少AAC3【4】。AAC的功能在之前被发现可能与线粒体解偶联与线粒体通透性膜孔(Permeability transition pore, PTP)【5】有关。提到线粒体解偶联,不得不提到的蛋白质家族是UCPs(Uncoupling proteins),主要的功能是调节H+在线粒体内膜转运。IH(H+leak)通过电子传递链以及ATP合成酶与H+流解偶联从而引起ATP产生的减少以及线粒体中生热反应的增加。IH通常还会减少ROS的产生,从而保护线粒体的完整性【6】。通过UCPs产生的IH是由游离的长链脂肪酸(Fattyacids, FA)激活的【7】。除了UCP之外还有多种蛋白包括AAC参与到IH产生之中。甚至于有的研究发现在没有蛋白参与的情况下,仅通过脂相的参与就可以引起的IH产生【8】。因此,线粒体解偶联的具体分子机制还没有一个统一的答案。PTP引起线粒体解偶联并且会造成线粒体功能异常以及细胞死亡。而且脂肪酸也会参与激活PTP,因此AAC对于脂肪酸依赖的线粒体解偶联是通过调节选择性的H离子IH还是通过非选择性的PTP还不得而知。
为了对IH进行测量,作者们使用了完整线粒体内膜膜片钳技术【9】(图2)。通过对不同小鼠中不同组织(骨骼肌、心脏、肾脏等等)中完整线粒体质体内膜进行测量,作者们发现在线粒体内膜上的确会产生脂肪酸依赖型IH,并且AAC会参与到脂肪酸依赖型IH产生之中(图3)。
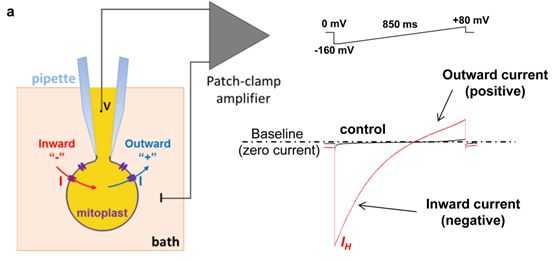
图2 线粒体内膜以及细胞膜上脂肪酸依赖型IH的产生(使用膜片钳对线粒体质体内膜电流进行测量原理示意图)
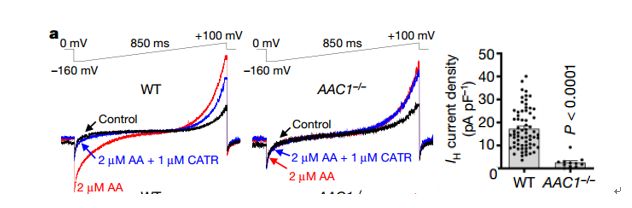
图3 AAC参与到脂肪酸以来的IH的产生
为了进一步验证AAC在线粒体解偶联过程中的作用,作者们建立了C2C12AAC1与AAC2双敲除的细胞系(AAC1/AAC2 DKO)。在野生型和DKO细胞系中,线粒体呼吸复合物和ATP合成酶的丰度、线粒体形态、每个细胞的线粒体生物量和线粒体DNA丰度总体相似。但是两者之间,解偶联的呼吸作用在DKO的细胞系中严重损坏。
UCP1转运H+和脂肪酸,同时也在脂肪酸阴离子与H+的共转运过程中发挥作用【9】。而Yuriy Kirichok研究组的工作发现AAC在所有不表达UPC1的组织中参与线粒体内膜H+的转运。而且跟前人观点不同的是,作者们发现UCP1的同源蛋白以及其他相关的蛋白质家族对于脂肪酸依赖型IH的产生并没有什么贡献。并且作者们发现脂肪酸在AAC介导的H+转运过程中是必须的。因此,作者们认为AAC可能是线粒体能量输出的主要调节因子并且负责在ATP产生和产热之间保持微妙的平衡。
原文链接:
https://www.nature.com/articles/s41586-019-1400-3
参考文献
1. Klingenberg,M. The ADP and ATP transport in mitochondria and its carrier. Biochimica et biophysica acta 1778, 1978-2021,doi:10.1016/j.bbamem.2008.04.011 (2008).
2. Ruprecht,J. J. et al. Structures of yeastmitochondrial ADP/ATP carriers support a domain-based alternating-accesstransport mechanism. Proceedings of theNational Academy of Sciences of the United States of America 111, E426-434,doi:10.1073/pnas.1320692111 (2014).
3. Ruprecht,J. J. et al. The Molecular Mechanismof Transport by the Mitochondrial ADP/ATP Carrier. Cell 176, 435-447 e415,doi:10.1016/j.cell.2018.11.025 (2019).
4. Graham,B. H. et al. A mouse model formitochondrial myopathy and cardiomyopathy resulting from a deficiency in theheart/muscle isoform of the adenine nucleotide translocator. Nature genetics 16, 226-234, doi:10.1038/ng0797-226 (1997).
5. Halestrap,A. P. & Richardson, A. P. The mitochondrial permeability transition: acurrent perspective on its identity and role in ischaemia/reperfusion injury. Journal of molecular and cellular cardiology78, 129-141,doi:10.1016/j.yjmcc.2014.08.018 (2015).
6. Korshunov,S. S., Skulachev, V. P. & Starkov, A. A. High protonic potential actuates amechanism of production of reactive oxygen species in mitochondria. FEBS letters 416, 15-18, doi:10.1016/s0014-5793(97)01159-9 (1997).
7. Wojtczak,L. & Schonfeld, P. Effect of fatty acids on energy coupling processes inmitochondria. Biochimica et biophysicaacta 1183, 41-57,doi:10.1016/0005-2728(93)90004-y (1993).
8. Gutknecht,J. Proton conductance caused by long-chain fatty acids in phospholipid bilayermembranes. The Journal of membranebiology 106, 83-93 (1988).
9. Fedorenko,A., Lishko, P. V. & Kirichok, Y. Mechanism of fatty-acid-dependent UCP1uncoupling in brown fat mitochondria. Cell 151, 400-413,doi:10.1016/j.cell.2012.09.010 (2012).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473141&idx=5&sn=8a09c7f6361314cf50d1ae14f0c0891b&chksm=84e21481b3959d9717ab4df174417ef77d6503accf0154013010f0508b9759a8325ba766672f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
短链脂肪酸
三甘油脂肪酸酯
反式脂肪酸之惧

脂肪酸可以杀死癌细胞
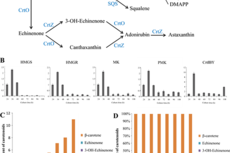
昆明植物所在海洋微藻类虾青素和DHA研究中取得进展


JACC文章:饱和脂肪酸不是“坏”脂肪酸!
一种脂肪酸可杀死癌细胞
脂肪酸甲酯
全球变暖或会威胁必需脂肪酸产量
利用脂肪酸可精确测定年代