科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-16
来源:生物通
这第一次成功地将诱导多能干细胞技术(iPSC)与CRISPR筛选技术结合在一起。
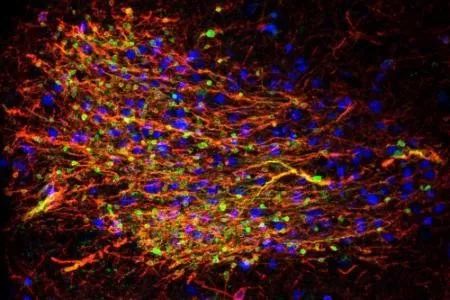
加州大学旧金山分校和NIH的科学家团队开发出了一种特殊版本的CRISPR,系统性改变干细胞产生的人类神经元中基因的活性,从而从根本上改变了科学家研究脑部疾病的方式。
这一重要发现公布在8月15日的Neuron杂志上,这第一次成功地将诱导多能干细胞技术(iPSC)与CRISPR筛选技术结合在一起。
虽然科学家们都知道突变和其他遗传变异与许多神经系统疾病的风险增加有关,但技术瓶颈阻碍了他们前进的步伐,无法了解这些基因究竟是如何引起疾病的。
加州大学旧金山分校神经退行性疾病研究所副教授Martin Kampmann博士(文章的通讯作者)说:“在这项研究之前,这一领域存在显著的限制,限制了科学家们对实验室中人类神经元展开深入探索。”
而且,直到最近科学家们才可以可靠地获得可用于高级实验的人脑细胞, “那些接受过脑组织切除治疗癫痫或脑癌的患者捐献神经元,但这些样本只能存活几天。你不能进行实验来探测活着的神经元的基因功能。”
因此科学家通常依赖于脑疾病的动物模型,这种模型无法捕捉到人类神经生物学的许多细微差别。
2006年京都大学和加州大学旧金山分校的Shinya Yamanaka发现了一种突破发育时钟,将成体细胞转化为干细胞的方法,这种方法可以将在体内发现的细胞类型,包括神经元转化为干细胞,这些“诱导多能干细胞”(iPSCs)让人脑细胞可以广泛用于实验室研究。
当CRISPR基因编辑系统在六年后到来时,科学家们认为他们最终拥有操纵人类神经元基因所需的所有工具。
但科学家们很快发现,CRISPR系统的DNA切割机制,一种叫做Cas9的酶,与iPSCs无法良好混合。“干细胞具有非常活跃的DNA损伤反应。当Cas9产生甚至只有一到两次DNA切割时,它会导致细胞死亡,”Kampmann说。
因此,Kampmann决定解决这个毒性问题,其研究组为此开发了CRISPRi(i for "interference")的工具,这是一种修饰过的CRISPR技术,其中Cas9酶已经失活。当CRISPRi找到它正在寻找的基因时,它会在不进行任何切割的情况下抑制其活动。因此,与标准CRISPR-Cas9不同,CRISPRi不会对iPSC或干细胞分化的神经元有毒。
在新论文中,Kampmann等人描述了他们如何将CRISPRi用于人类iPSC和iPSC衍生的神经元,发现它可以靶向并干扰基因而不会杀死细胞,后者是一个长期以来一直困扰着科学家的问题。
研究人员利用这一系统描述了如何利用这个技术寻找可能导致脑部疾病的基因。例如,他们找到了特异性延长神经元寿命的基因,但这个基因对于iPSC或癌细胞没有同样的作用,他们还发现了增加神经突数量的基因 ,并确定它们分支的频率。
但最令人惊讶的发现之一是发现了“管家”基因,这是一些对于生存至关重要,在所有细胞中都发挥相同作用的基因(实际上在神经元和干细胞中表现不同)。
当研究人员在这两种细胞类型中干扰相同的管家基因时,细胞通过激活(或灭活)一组完全不同的基因来应对。这一结果表明,与已有观点不同,在不同的细胞类型中的管家基因可能不会以相同的方式运作,这是Kampmann实验室下一步希望进一步探索的一个观点,这些差异可能在疾病中起重要作用。
Kampmann现在利用该技术研究不同类型的神经元,分析为什么某些疾病选择性地影响一部分神经元,例如运动神经元在ALS中被选择性损伤。他还将研究扩展到其他类型的脑细胞,比如星形胶质细胞和小胶质细胞。
最终,他们的目标是将这种将CRISPRi和iPSCs结合起来的技术转变为一种工具,可以揭示治疗脑疾病急需的新治疗方法。
“该领域面临的一大挑战是,对于大多数这些疾病,我们对药物开发的精确分子途径仍不了解,”文章的另外一位作者Michael Ward博士说。
“通过这项技术,我们可以从患有阿尔茨海默症等神经退行性疾病的患者身上获取皮肤或血细胞,将其转化为神经元或其他脑细胞,找出哪些基因控制与该疾病相关的细胞缺陷,”Kampmann说,“这些信息可能使我们能够确定有效的治疗目标。”
来源:gh_c1fce5726992 生物通
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675530332&idx=2&sn=7fbf97d30b81f3be91780a5151abb926&chksm=bc51f3cd8b267adbed0f16deb9d146d2b6265007d6609a46810c18831f4295919d09fc8ca56b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

人类皮肤细胞直接“变身”运动神经元
脑损伤激活胶质细胞产生神经元研究获进展
中国科协发布2016年度“中国生命科学领域十大进展”
遗传发育所揭示成体神经干细胞促进其子代新生神经元发育的调控机制
纳米医药通过沉默长非编码RNA引导神经干细胞分化为神经元用于脑中风治疗
星形胶质细胞首次转为功能性神经元

中国科学家培育出基因编辑瘦肉猪:脂肪少24%
中国首个干细胞通用标准发布,规范国内行业发展
皮肤变肌肉不再是幻想,科学家们做到了!
大脑“后勤”细胞参与指挥神经元发育