科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-23
来源:ScienceAAAS

评述论文:N6-methyladenosine RNA modification–mediated cellular metabolism rewiring inhibits viral replication(Science 23 AUGUST 2019: Vol 365 Issue 6455)
m6A修饰研究作为当前生命科学领域最热门的方向之一,其研究进展喜人,让人目不暇接。究其原因,主要是因为近年来m6A修饰的功能与分子机制方面取得了巨大进展,它已被证实在癌症发生发展,病毒感染,神经发育,干细胞分化等过程中发挥着关键作用。
病毒作为一种非细胞结构的特殊生物,它由一个核酸长链和蛋白质外壳构成,没有自己的代谢机构,没有酶系统。因此病毒离开了宿主细胞,就成了没有任何生命活动、也不能独立自我繁殖的化学物质。当病毒侵入细胞后,它能够很大程度的利用宿主的代谢产物来进行自我复制。但宿主细胞同样也能够通过改变自身的代谢情况来削弱病毒的复制增殖[1]。然而,作为RNA 上最丰富的m6A修饰在连接宿主代谢和病毒复制过程中的作用需要深入的研究。
本期《科学》杂志,中国医学科学院(暨北京协和医学院)基础医学研究所曹雪涛院士(现南开大学校长)团队阐述了RNA m6A去甲基化酶ALKBH5通过调节宿主细胞的三羧酸循环代谢通路调控病毒在细胞内的复制增殖。这一研究是2017年曹雪涛院士团队在《自然•免疫学》杂志上发表的ALKBH5通过结合DDX46在宿主抗病毒作用机制研究上更深入的延续[2]。
文章首先通过筛选发现,当分别敲低m6A 甲基转移酶组分METTL3、METTL14、WTAP和去甲基化酶ALKBH5、FTO时,敲低去甲基化酶ALKBH5能够最显著的减少VSV (Vesicular Stomatitis Virus)病毒的RNA含量,并且小鼠缺失ALKBH5能够抵御VSV病毒感染诱导的死亡。有意思的是,ALKBH5缺失小鼠相比于野生型小鼠反而显著减少了病毒引起的一型干扰素(Type I IFN)的产生,这说明ALKBH5是通过一种天然免疫非依赖的方式来促进病毒的复制。
为了进一步阐述ALKBH5在抗病毒上的作用机制,明确其抗病毒作用是否依赖于它的去甲基化酶活性,曹雪涛等人对ALKBH5进行了m6A去甲基化酶活位点的突变。同时,通过“功能获得”(gain-of-function)验证发现病毒的复制是依赖于ALKBH5的m6A去甲基化酶活性的。接下来,进一步明确了在病毒感染过程中,宿主会通过对ALKBH5蛋白的R107去甲基化主动衰减ALKBH5的去甲基化酶活来抑制VSV病毒复制过程(图1)。这可能是机体在与病毒协同进化过程中衍生出来的一种抗病毒机制。

图1. 宿主细胞通过ALKBH5蛋白的R107去甲基化降低ALKBH5的RNA m6A去甲基化酶活性来抑制病毒复制
研究进一步通过RNA-seq比较病毒感染后8小时的野生型与ALKBH5缺失细胞的基因表达变化,发现Alpha-ketoglutarate dehydrogenase(OGDH)基因在ALKBH5缺失后显著下调。OGDH在三羧酸循环(TCA)中能够将a-酮戊二酸转化为琥珀酰辅酶A。这提示宿主很可能通过降低ALKBH5的酶活对TCA循环代谢环路进行重编程(reprograming)来抑制病毒复制。有意思的是,无论是在病毒感染过程中还是宿主缺失ALKBH5都能够显著降低OGDH的表达。由于OGDH在TCA循环中的重要作用,通过分析OGDH敲低后巨噬细胞在病毒感染后改变的TCA循环的代谢中间产物,研究筛选到Itaconate,并通过体内外实验阐明Itaconate能够促进病毒的复制过程。因此,研究揭示了ALKBH5可通过上调OGDH-Itaconate信号轴来促进病毒的复制。
由于ALKBH5已被证实是m6A的去甲基化酶,它是否直接通过对OGDH mRNA 进行m6A去甲基化来调控OGDH的表达呢?通过系列的m6A-seq及ALKBH5 iCLIP-seq,研究证实ALKBH5可结合OGDH mRNA 并且介导它的m6A修饰去甲基化。m6A结合蛋白YTHDF2已被报道可通过结合m6A修饰的mRNA促进其降解,曹雪涛等人进一步明确了YTHDF2通过结合OGDH mRNA上的m6A修饰来促进其降解过程。同时,通过mRNA半衰期实验发现ALKBH5能够显著提高OGDH mRNA的半衰期(图2)。
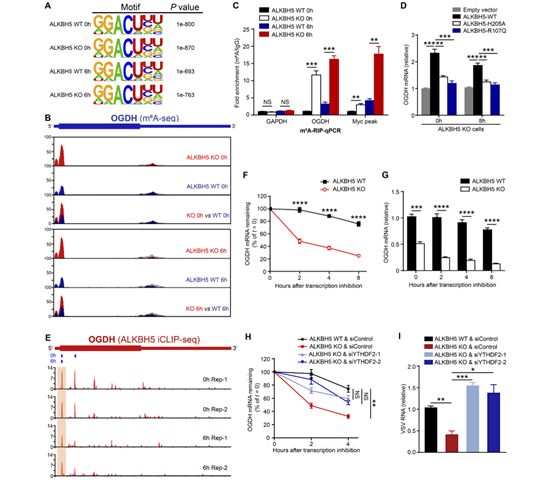
图2. ALKBH5直接对OGDHmRNA进行去m6A修饰增强其稳定性
因此,该项工作明确了ALKBH5通过对OGDH mRNA进行m6A去甲基化,降低YTHDF2对OGDH mRNA的结合能力,抑制了YTHDF2降解OGDH mRNA的活性,进而影响到Itaconate表达。在病毒感染过程中,宿主细胞会通过ALKBH5蛋白的R107去甲基化来降低ALKBH5的去甲基化酶活,导致了OGDH和Itaconate的表达下调,抑制了病毒复制过程(图3)。该研究阐明了ALKBH5介导的去m6A修饰通过重编程宿主细胞的OGDH-Itaconate代谢通路来促进病毒的胞内复制,为人类的抗病毒感染提供了潜在的靶点。
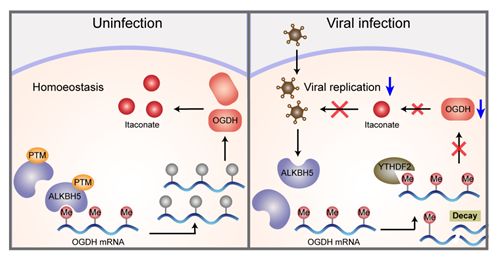
图3. 宿主细胞通过下调ALKBH5-OGDH-Itaconate 信号轴抑制病毒复制
中国科学院北京基因组所副研究员,中国科学院青年创新促进会会员。主要从事以m6A和m5C修饰为主的表观转录组学功能调控及机制研究。
参考文献:
1. A. J. Olive, C. M. Sassetti, Metabolic crosstalk between host and pathogen: Sensing, adapting and competing. Nat. Rev. Microbiol. 14, 221–234 (2016).
2. Q. Zheng, J. Hou, Y. Zhou, Z. Li, X. Cao, The RNA helicase DDX46 inhibits innate immunity by entrapping m6A-demethylated antiviral transcripts in thenucleus. Nat. Immunol. 18, 1094–1103 (2017).
来源:Science-AAAS ScienceAAAS
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDY3NzQ2Mg==&mid=2247487881&idx=3&sn=5f5ecf14b81c334b9d5113bcff56dfdb&chksm=eb113a30dc66b3264c1df2294b2656c287ce2078ae1ba9d8f1e055234c6d1e40cd04f15ff0a2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
植物DNA去甲基化的机理和功能
Nature: 能催化RNA甲基化的核酶!
PdZn/TiO2催化剂上CO2作为甲基化试剂的N-甲基化反应
Nat Plants:植物如何防晒?抑制DNA甲基化
Blanc 氯甲基化反应

抽管血,揪出癌症“指纹”

生物钟调控代谢新方式揭示

肠癌血浆DNA甲基化检测——数字PCR技术

是什么让脊椎动物如此特别