科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-04
来源:BioArt
大脑,作为我们身体中最复杂的器官,拥有一个极其复杂的神经细胞网络。在这个网络中,每一个神经细胞通过成千上万个神经突触与其它的神经细胞进行信息交流。交流的方式主要包括电信号和化学信号两类。以大脑中最主要的一类兴奋性神经突触为例,在电信号的驱动下,突触前膜释放出兴奋性神经递质——谷氨酸。谷氨酸通过扩散的方式越过突触间隙,结合并激活位于突触后膜的谷氨酸受体,并进一步导致突触后膜的去极化。在这个过程中,谷氨酸化学信号通过将突触前膜的电信号转化成为突触后膜的电信号,完成了两个神经细胞之间的信息交流。
大脑中最主要的离子型谷氨酸受体有两类:AMPA受体和NMDA受体。其中,AMPA受体介导了大脑中绝大多数突触后膜的快速去极化。然而,与它的功能看似矛盾的地方在于,AMPA受体与谷氨酸的亲和力并不强,远弱于NMDA受体与谷氨酸的亲和力。这意味着如果AMPA受体不能被精确地锚定在谷氨酸释放位点附近,则难以被谷氨酸高效地激活。那么,什么样的分子机制能确保AMPA受体的精准定位与激活呢?
在被突触前神经细胞释放之前,谷氨酸储存在位于轴突末梢的突触小泡中。突触前膜上有一块高度特异化的区域被称之为active zone。突触小泡通过与active zone融合,将储存的谷氨酸释放至突触间隙中。与active zone相对应的是,突触后膜上也有一块高度特异化的区域,称之为突触后致密区(postsynaptic density,PSD),负责大脑信号的处理和传递。Active zone 和PSD面对面地排列在突触间隙两侧。从active zone释放的谷氨酸在跨越突触间隙后首先抵达的区域即是PSD。可以想像,如果AMPA受体能被高度富集在PSD中,则能更大程度地确保其被谷氨酸激活。
PSD中最大量的一类支架蛋白(scaffold protein)是以PSD-95为代表的MAGUK家族成员。以往的实验表明,在神经细胞中过表达PSD-95,会增强AMPA受体介导的突触电信号传递。而在神经细胞中同时knock down多个MAGUK家族成员,则会减弱AMPA受体的PSD定位和突触电信号传递。这一系列的实验都指向AMPA受体与MAGUK家族之间高度特异的相互作用。然而,有意思的是,AMPA受体的PSD定位并不取决于它自身与MAGUK的直接相互作用,而是由一类名为TARP(transmembrane AMPAR regulatory protein)的辅助型亚基介导完成的。TARP是一个四次跨膜蛋白,一方面通过其跨膜区域和胞外区域与AMPA受体绑定,另一方面通过其胞内区域与MAGUK结合。我们过去对于这一结合模式的认识仅限于TARP的C末端有一个PDZ结合序列(PDZ binding motif,PBM),能与MAGUK蛋白上的PDZ结构域弱相互结合。但考虑到细胞内有近三百个PDZ结构域,这种结合模式显然不能解释TARP与MAGUK之间高度特异的相互作用,也不能解释如何将AMPA受体高度富集在PSD中。
香港科技大学的张明杰教授团队长期以来致力于突触结构与功能的研究。在传统的结构生物学和生物化学的基础上,张明杰团队于2016年在Cell杂志上发表文章【1】,首次提出突触蛋白的相分离可能是PSD形成和可塑性调节的分子机制。在此基础上,两年后的2018年,张明杰团队再次在Cell杂志上发表文章【2】。通过相分离的方式,该团队在体外系统中首次用纯化的突触蛋白重塑出类似PSD的结构。该结构能重现出PSD在神经细胞内的一系列关键功能(详见BioArt报道:Cell丨张明杰组破解突触的建立与可塑性调节的机制)。
在过去的几年中,生命科学领域涌现出一系列关于生物大分子相分离的研究。生物大分子的相分离被认为可能是细胞内无膜分隔型区域化组织的分子基础。目前,绝大部分的相分离研究都集中在细胞胞浆大分子或者细胞核内大分子的相分离,即三维空间内的生物大分子如何通过相分离聚集在无膜包裹的亚细胞结构中。值得注意的是,细胞中有大量的功能性蛋白是嵌合在磷脂双分子层中的跨膜蛋白。这些跨膜蛋白能在二维的磷脂膜内自由流动,但为了完成其特定的生物学功能,它们需要被锚定到特定的区域。以AMPA受体为例,为了与突触前膜释放的谷氨酸结合,AMPA受体需要被富集到PSD区域,而不能在整个神经细胞的细胞膜中无差别地分布。那么,这种跨膜蛋白二维层面的富集是否也依赖于生物大分子的相分离呢?
2019年9月3日,张明杰团队在Neuron杂志上发表文章Phase Separation-Mediated TARP/MAGUK ComplexCondensation and AMPA Receptor Synaptic Transmission,解析了TARP CT与MAGUK相分离的分子机制。

研究人员首先纯化出TARP家族成员整个C端胞内段的蛋白(TARP CT)。令人惊讶的是,TARP CT呈现出远高于PBM的与MAGUK家族的亲和强度。更有意思的是,TARP CT与MAGUK全长蛋白能在近似生理条件和蛋白浓度下发生典型的相分离现象。与MAGUK蛋白结合后,TARP CT蛋白会自发地富集在浓缩相(condensed phase)中,且该过程并不依赖磷脂膜的分隔。张明杰团队进一步综合运用生化和核磁研究手段,解析出TARP CT与MAGUK相分离的分子机制。除去PBM与PDZ结构域的相互作用以外,TARP CT上有一段高度保守的Arg motif,能与MAGUK PDZ1上一个同样保守的负电表面相互作用。这种TARP-MAGUK之间多价态的相互作用促进了相分离的产生。将这些序列突变后,两个蛋白之间的亲和力与相分离能力都相应地减弱。
考虑到TARP本身是一个跨膜蛋白,为了更好地模拟TARP CT在生理状态下的构象以及与磷脂膜之间可能的相互作用,该团队进一步生化重塑出带负电的磷脂双分子层结构。在该重塑结构中,TARP CT的运动被限定在二维磷脂膜上,且磷脂膜中的PIP2负电基团会与TARP CT上的Arg motif结合,减缓TARP CT的流动。在该体系下,MAGUK和其它的PSD支架蛋白复合物仍能引发TARP CT产生相分离,意味着跨膜蛋白胞内段与胞浆蛋白的多价态相互作用能促进跨膜蛋白在二维层面的相分离。
目前,大多数生物大分子相分离的研究局限于体外系统,或者简单的细胞系系统。如何在复杂的生理条件下(比如,神经系统中)验证相分离的生理学功能将是制约相分离领域发展的瓶颈。为了验证TARP/MAGUK相分离对于AMPA受体生理功能的作用,张明杰团队和UCSF的Roger Nicoll团队展开合作。哺乳动物的大脑中有多个AMPA受体家族成员和多个TARP家族成员。不同的家族成员间能相互组合。因此,简单的过表达或者单一成员的基因敲除无法提供干净的遗传背景。该研究团队首先特定地敲除海马脑区中最主要的AMPA受体成员(GluA1/2/3),同时表达共价连接的GluA1-TARPγ-8. 这样,海马神经细胞中多样化的AMPAR-TARP组合被归一为GluA1-TARPγ-8组合。接着团队在TARPγ-8的胞内区域引入一系列体外实验中验证过的突变。电生理研究发现,引入突变后,AMPA受体的EPSC相应地变弱了,但其本身的膜表达能力没有变化。这意味着AMPA受体的生成过程没有缺陷,但其PSD定位能力变弱了。而突变并不改变NMDA受体的EPSC,验证了TARP对AMPA受体PSD定位的特异性调节。
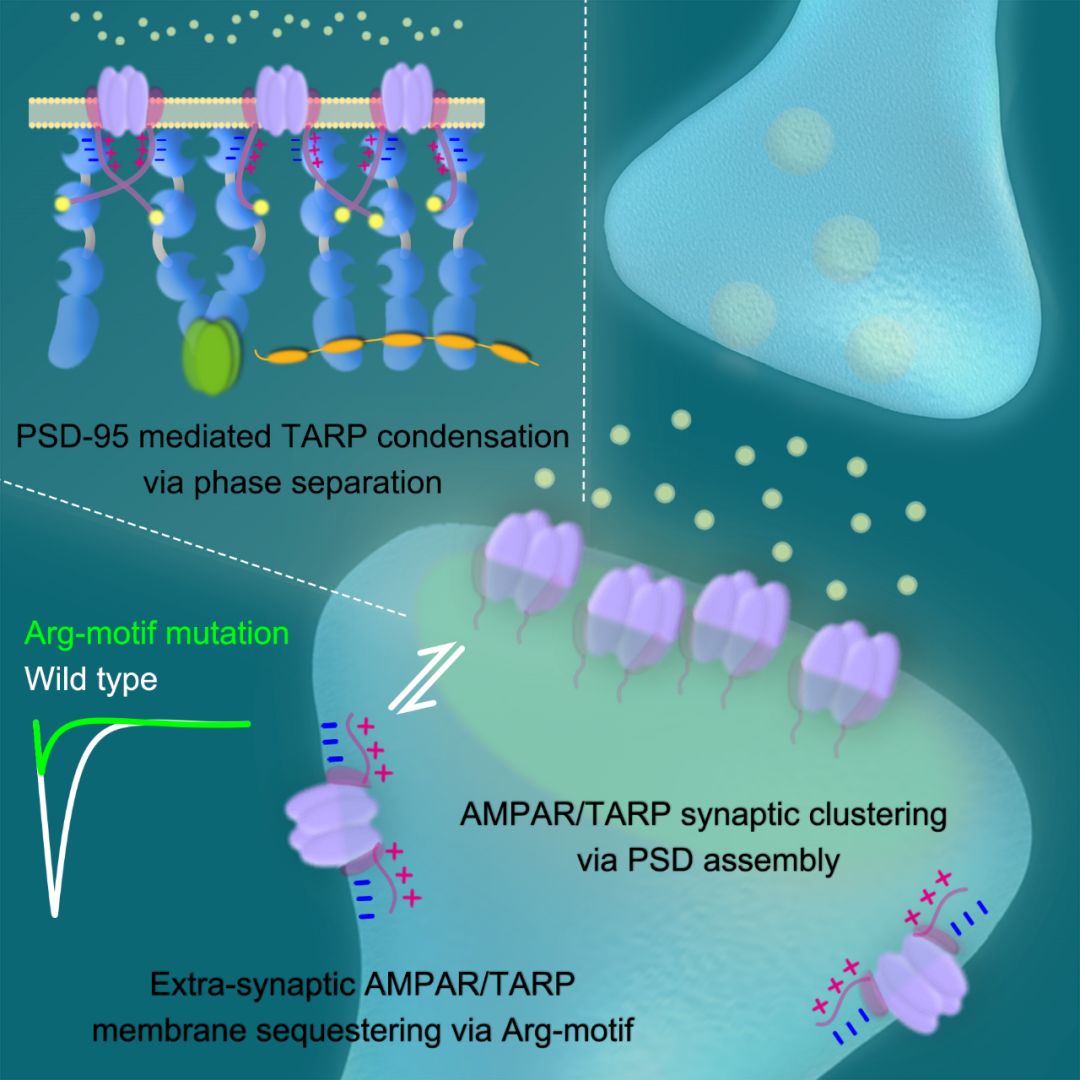
图:通过相变锚定及富集AMPA受体于神经细胞突触后致密区
该项关于TARP/MAGUK相互作用和相分离的研究,综合运用了生物化学,结构生物学和电生理等多领域的研究手段,不仅对我们了解兴奋性突触的组织和调控有重要的指导意义,也将相分离的研究引申至跨膜蛋白二维层面的区域化组织机制。
据悉,该文章的一作是香港科大博后曾梦龙,UCSF的博后Javier Diaz Alonso是该文章的共同一作。值得一提的是曾梦龙博士也是张明杰团队在2016、2018年关于突触相变两篇Cell文章的一作【1,2】。
原文链接:
https://doi.org/10.1016/j.neuron.2019.08.001
参考文献
1. Zeng, M., Shang, Y., Araki, Y., Guo, T., Huganir, R.L., and Zhang, M. (2016). Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175.
2.Zeng, M., Chen, X., Guan, D., Xu, J., Wu, H., Tong, P., and Zhang, M. (2018). Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell 174, https://doi.org/10.1016/j.cell.2018.06.047.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474815&idx=3&sn=ef46e3cbab327fb375094c7c2fc2a86a&chksm=84e21e0bb395971d943e27abdf136886970f2913d6270f96f557bea702a30632d31766e96b57&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
N-邻苯二甲酰-L-谷氨酸

赵岩/石云/张凯合作揭示谷氨酸受体GluK2的调控机制

【学术前沿】Nature | 赵岩/石云/张凯课题组合作揭示谷氨酸受体GluK2的调控机制
耶鲁吴殿青组发现中性粒细胞极化新机制

Cell Reports | 马聪团队报道时序性调控突触分泌的过程
遗传发育所等在不同谷氨酸受体亚型配比的调控机制研究中获进展
L-谷氨酸钠
N-乙酰-L-谷氨酸
H-谷氨酸-Obzl

两篇science背靠背,新的研究热点或将开启