科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-05
来源:药学进展
2019年9月3日,国际知名学术期刊《Nature Cell Biology》以长文形式在线发表北京大学分子医学研究所张岩、肖瑞平团队题为“CaMKII-δ9 promotes cardiomyopathy through disrupting UBE2T-dependent DNA repair”的研究成果(https://www.nature.com/articles/s41556-019-0380-8)。该研究发现人类心脏中最主要的钙/钙调素依赖的蛋白激酶II(Ca2+/calmodulin protein kinase II, CaMKII)亚型CaMKII-d9通过损害范可尼贫血(Fanconi anemia,FA)通路依赖的DNA修复机制,导致心肌细胞DNA损伤聚集和基因组不稳定,进而引起心肌细胞死亡以及后续的心力衰竭等心血管疾病。
成年哺乳动物的心肌细胞是终末分化细胞,增殖能力非常有限,而很多外界刺激以及细胞内代谢产物等都会引起心肌细胞DNA损伤,如果损伤的DNA不能得到有效修复,会引起DNA损伤的积累和基因组稳定性下降,进而造成心肌细胞死亡和多种心血管疾病。然而,目前对心肌细胞DNA损伤修复的调节机制还知之甚少。
张岩和肖瑞平团队的工作利用第三代测序和绝对定量质谱技术,首次发现人类心脏中最主要的CaMKII-d的可变剪切体是CaMKII-d9亚型,而不是以前广泛认为的d2和d3。利用病人心脏样本、人诱导多功能干细胞、以及多种大、小鼠心脏损伤模型,他们发现在心脏病理情况下,CaMKII-d9表达增加,直接结合并磷酸化FA通路唯一的泛素耦联酶E2T(Ubiquitin-conjugating enzyme E2T, UBE2T),并造成该蛋白的降解,从而损害FA通路的DNA修复功能,引起心脏DNA损伤和心肌细胞的死亡,进而引发心肌病和心力衰竭。CaMKII-d9特有的肽段是其特异性结合并降解UBE2T的基础,而其他常见的CaMKII-d可变剪切体,包括d1,d2和d3,均不具备上述调控功能。
此工作首次揭示了一种全新的CaMKII-d9依赖的心肌细胞DNA损伤和修复机制,及其在心肌细胞死亡,心肌病和心力衰竭等重大疾病中的作用。研究提示,通过抑制该调控通路的过度激化,可为包括心脏缺血、恶性重构和心力衰竭等重大心血管疾病的预防和治疗提供新途径。
北京大学分子医学研究所张茂博士为该论文的第一作者,张岩副研究员为论文的通讯作者,肖瑞平教授为资深作者。北京大学分子医学研究所李川昀教授和胡新立副研究员、阜外医院宋云虎教授、国家蛋白质科学中心(北京)秦钧教授和安贞医院兰峰教授,及他们的研究团队为该工作提供了大力支持。该项研究得到科技部重点研发计划、国家自然科学基金委、北京市生命科学前沿创新培育项目、北京市自然科学基金、北大-清华生命科学联合中心、生物膜与膜生物国家重点实验室和北京市重点实验室的资助。
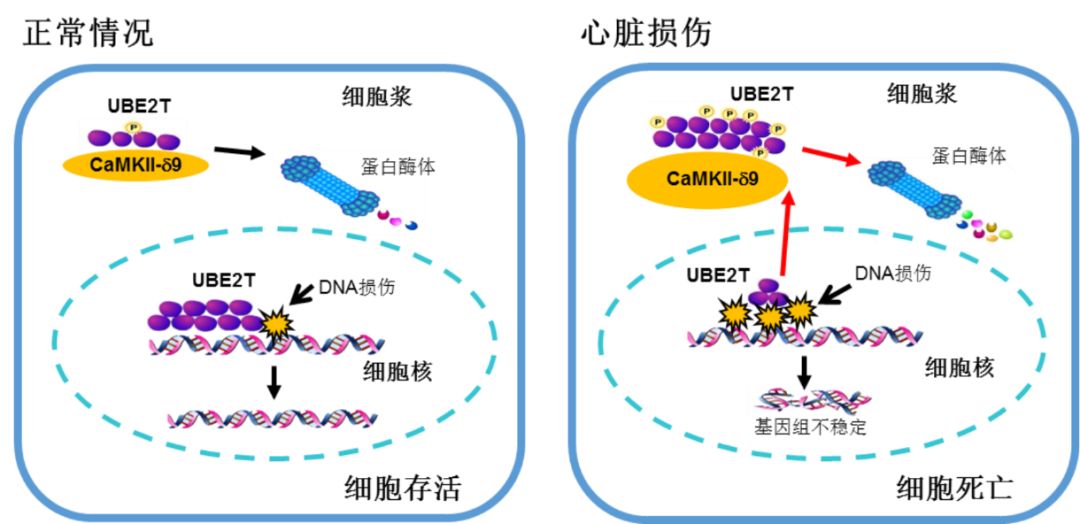
图注:CaMKII-d9调节心肌细胞DNA损伤和细胞死亡的机制。当心肌细胞受损伤时,CaMKII-d9上调,促进UBE2T的磷酸化和降解,导致DNA修复障碍、DNA损伤的富集和基因组的不稳定,最终引起心肌细胞死亡。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651306739&idx=3&sn=fe017558ccc4912271490eae16c0aa7a&chksm=8bf4ecffbc8365e958df747a5f913ec09de8274165dd240289c2c145734f3d0f44376282ed42&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

ICH M4药学申报资料要求及行政文件和药品信息要求培训会在顺利北京召开
2018年中国药学会药学网络大讲堂--药品质量管理与用药安全管理(第一期)在北京开讲



中国药学会关于发布第六批过度重复药品提示信息的公告
宁夏药学会发动会员单位捐赠抗疫防炎药品
中国抗癌协会抗癌药物专业委员会召开换届会议




太原市药学会 举办《药品法及近期政策》专题讲座
ICHM4药学申报资料要求及行政文件和药品信息要求培训会在顺利北京召开



中国抗癌协会肿瘤药物临床研究专业委员会成立



【抗“疫”】宁夏药学会发动会员单位捐赠抗疫防炎药品
【新科技知识干部读本】海洋药物研究有利于新药研发