科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-15
来源:BioArt
cGAS-STING(the stimulator of interferon genes)通路能够感知细胞内的dsDNA,激活干扰素基因的表达,保护机体抵抗感染。一旦感知到dsDNA,c-GAS(cyclic-GMP-AMP-synthase)催化GTP和ATP形成第二信使2’3’-cyclic-GMP-AMP(cGAMP)。cGAMP结合并激活位于内质网膜的受体STING,活化的STING招募TBK1和IRF-3,导致IRF-3磷酸化。磷酸化的IRF-3二聚体入核,诱导I型干扰素的表达和分泌。
STING通路在抗病毒、抗细菌及抗肿瘤免疫中有重要作用。STING缺失的小鼠对DNA病毒和逆转录病毒如HIV等更易感。瘤内注射STING的激动剂对多种小鼠肿瘤模型有显著的治疗效果,其中两项相关临床试验(NCT03172936和NCT03010176)已经开展。与此相对,STING通路的过度激活参与系统性红斑狼疮SLE、多发性硬化MS等多种自身免疫疾病的病理过程,同时参与心肌梗塞的急性炎症和肝脏疾病、胰腺炎中的慢性炎症反应。而且,STING中的6个点突变被报道导致STING过度活化,造成婴儿期发生自体免疫综合症STING相关的血管病(SAVI)【1】。然而,STING如何被配体激活,STING如何保证对dsDNA的反应的同时不导致自身免疫疾病,这些问题还有待进一步的研究。
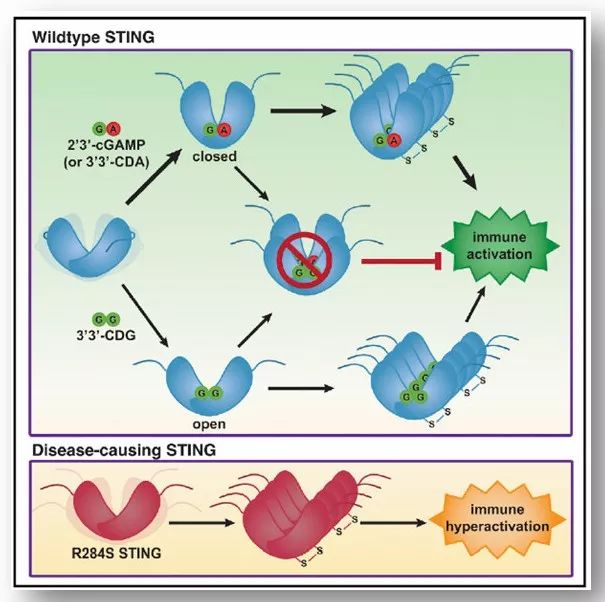
近日,来自美国斯坦福大学的Lingyin Li教授在Cell杂志上发表文章 STING Polymer Structure Reveals Mechanisms for Activation, Hyperactivation, and Inhibition 。研究利用结构生物学和生物化学的手段揭示了cGAMP结合促进STING同源二聚体的形成并释放C端结构域。STING的C端尾巴是形成多聚化的界面,通过氨基酸C148的二硫键连接形成低聚体,导致STING活化。疾病相关的突变通过影响C端的开放和多聚化过程,使STING处于过度活化的状态。细菌的CDG(cyclic-di-GMP)诱导apo STING发生构象改变,以合作的方式活化,部分拮抗cGAMP的信号通路。

环二核苷酸(cyclic dinucleotide,CDN)cGAMP是已知的STING的配体,非常高效地激活STING。其他CDN如CDG(cyclic-di-GMP)和CDA(cyclic-di-AMP)是细菌中普遍的信号分子,能够激活小鼠中的STING通路【2,3】。但小鼠和人源STING对配体的选择性非常不同,作者探索了cGAMP、CDA和STING的结合。他们分别获得了cGAMP和CDA直接结合STING的晶体。研究表明cGAMP和CDA均能导致人源STING形成二聚体闭合结构,其角度与小鼠STING类似,CDA和人源STING的直接结合属首次发现。
配体的结合导致位于STING聚合,但STING如何聚合以及聚合的STING如何活化?研究发现,STING的低聚体形成不需要翻译后修饰后,作者推测其聚化发生在内质网上,在运输到高尔基体之前。因此作者进一步鉴定了获得的STING晶体晶格排布,发现聚合的STING的N端在同一平面上形成线性多聚体,可通过跨膜结构域锚定在内质网膜上。而apo STING二聚体则以“头对头”“尾对尾”的形式存在,不利于定位到膜上。之前的假说认为,STING的胞质结构域可以结合其C端尾巴(C-terminal tail,CTT),配体的结合释放CTT,CTT的释放被认为促进STING的聚合。作者发现纯化的STING-ΔCTT极易聚合,没有配体结合依然形成聚合体,呈核周点状分布在细胞中。这个证据表明未激活的情况下,CTT可结合STING的低聚化作用界面,从而抑制STING的聚合,实现自抑制。共沉淀实验证明CTT和STING-ΔCTT的相互作用,cGAMP的结合促进CTT的释放。过表达CTT抑制STING的运输及下游IRF-3的磷酸化、IFN-β的表达。
STING的聚合在有还原剂DTT的溶液中不能形成【4】,研究团队对这一现象进行深入调查。他们发现配体的结合使两个STING分子的胞内结构域部分形成二硫键,稳定STING多聚体。其中位于配体结合结构域和跨膜结构域的连接区域的C148,对二硫键的形成至关重要。cGAMP能够诱导STING形成二硫键,C148在cGAMP结合的STING间形成二硫键,形成二聚体间的交联,促使STING聚合体活化;但突变STING-C148A则阻断了STING的活化过程。其中,SAVI诱发的STING突变V147L、N154S、V155M位于C148附近,能够导致STING过度活化,其中V147L、N154S的作用依赖于C148。
总的来说,此项工作研究了正常情况和病理条件下,STING的聚合过程及活化过程中的构象变化,同时阐释了细菌CDG抑制cGAMP-STING的机制,为研究和靶向STING通路提供了新的思路。其中C148二硫键的形成促进了STING多聚化的发现为进一步研究cGAS-STING通路的调控提供了新的方向;而C148二硫键也需要更多细胞原位实验证据的支持。
原文链接:
https://doi.org/10.1016/j.cell.2019.05.036
参考文献
1. Saldanha, R. G. et al. A Mutation Outside the Dimerization Domain Causing Atypical STING-Associated Vasculopathy With Onset in Infancy. Front. Immunol. 9, 1535, doi:10.3389/fimmu.2018.01535 (2018).
2. Chin, K. H. et al. Novel c-di-GMP recognition modes of the mouse innate immune adaptor protein STING. Acta Crystallogr. D Biol. Crystallogr. 69, 352-366, doi:10.1107/S0907444912047269 (2013).
3. Jin, L. et al. MPYS is required for IFN response factor 3 activation and type I IFN production in the response of cultured phagocytes to bacterial second messengers cyclic-di-AMP and cyclic-di-GMP. J. Immunol. 187, 2595-2601, doi:10.4049/jimmunol.1100088 (2011).
4. Li, Z. et al. PPM1A regulates antiviral signaling by antagonizing TBK1-mediated STING phosphorylation and aggregation. PLoS Pathog. 11, e1004783, doi:10.1371/journal.ppat.1004783 (2015).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475294&idx=4&sn=25fe28149cef0fd1a2a6043ff227ead9&chksm=84e21c2ab395953c119527a1d13e70fb0daf290820cb808645cb7dd3172c5fb87cfb19090751&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn