科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-26
来源:BioArt
肿瘤免疫治疗是最近发展起来的一种有效的肿瘤治疗手段,相关的发现于去年获得诺贝尔生理学或医学奖。肿瘤的免疫治疗无疑为成为继肿瘤放化疗治疗手段后又一有效的治疗手段。相关的介导肿瘤免疫治疗的分子不断的被发现【1,2】,新的概念不断地被提出,为肿瘤治疗带来了全新曙光【3】。
但是免疫治疗仍然存在一些缺陷,比如导致自身的过度免疫反应,以及癌细胞对免疫反应的耐受【4】。对于免疫治疗耐受的机制的研究一直是相关领域的热点,相关机理的精细研究将为肿瘤治疗带来新的方法以及思路。2018年2月,X. Shirley Liu与 Kai W. Wucherpfennig课题组合作,在Science上表了题为A major chromatin regulator determines resistanceof tumor cells to T cell–mediated killing 的文章【5】,通过使用Crispr based whole genome screening 的方法,发现了染色质重塑复合物(chromatin remodeling complex,SWI/SNF)ARID2、PBRM1和 BRD7等基因在肿瘤的免疫耐受中发挥着重要的作用。近日,通过基因组范围大规模基因筛选,发现小鼠中ADAR1缺失 (Adar1-null) 的黑色素瘤模型对抗PD1治疗更敏感,ADAR1可能作为潜在的治疗靶点【6,7】(详见BioArt报道:专家评述Nature+Nat Med丨RNA编辑酶ADAR1或可成为癌症免疫治疗新靶点)。
2019年9月5日,来自以色列Sheba医学中心Gal Markel和Tel Aviv University的Tamar Geiger课题组(Tamar Geiger课题组一直致力于使用高精度质谱的方法鉴定肿瘤治疗的潜在靶点)在Cell杂志发表了题为Proteomics of Melanoma Response to Immunotherapy Reveals Mitochondrial Dependence的文章,使用了高精度蛋白质组学的方法,鉴定了黑色素瘤抵抗免疫治疗可能的机制。

作者收集了42位经历TIL (Tumor infiltratinglymphocyte based immunotherapy)治疗以及72位经历anti-PD1治疗的黑色素瘤病人的样本,将病人样本按照对TIL以及anti-PD1治疗是否敏感分为两组,对其使用高精度蛋白质组学鉴定其蛋白表达谱的差异,试图找出不同病人对免疫治疗是否敏感的原因。
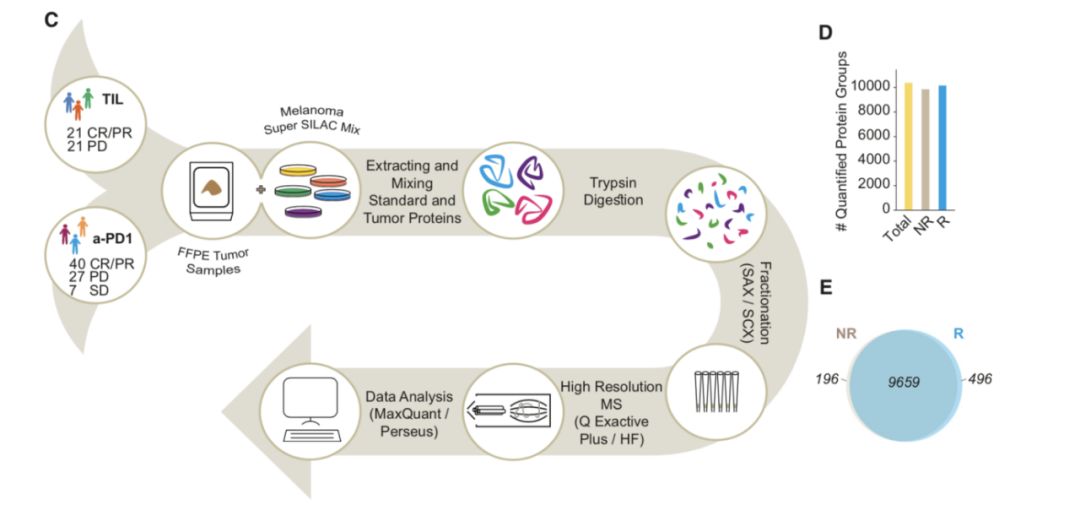
作者对蛋白质组学做了详细的分析,发现在对TIL以及anti-PD1治疗敏感组中,代谢相关的蛋白以及参与抗原呈递相关的蛋白高度富集。在不敏感组中,剪切体以及RNA代谢相关蛋白高度富集。作者关注与代谢相关的蛋白是否影响了黑色素瘤对于免疫治疗的敏感性。进一步详细的分析发现,在对于免疫治疗敏感的组别中,参与了线粒体代谢通路(三羧酸循环、脂代谢、酮体生成等代谢途径)的相关蛋白高度富集。为了证实线粒体能量代谢确实会影响免疫治疗的敏感性,作者使用了促进线粒体代谢的药物以及抑制线粒体代谢的药物分别处理细胞后,使用蛋白质组学手段分析细胞蛋白表达谱的变化,作者也发现,当线粒体能量代谢被增强时,细胞的抗原呈递过程显著增强(主要通过MHC class Imachinery)。反之,当线粒体能量代谢被抑制后,抗原呈递过程显著降低。
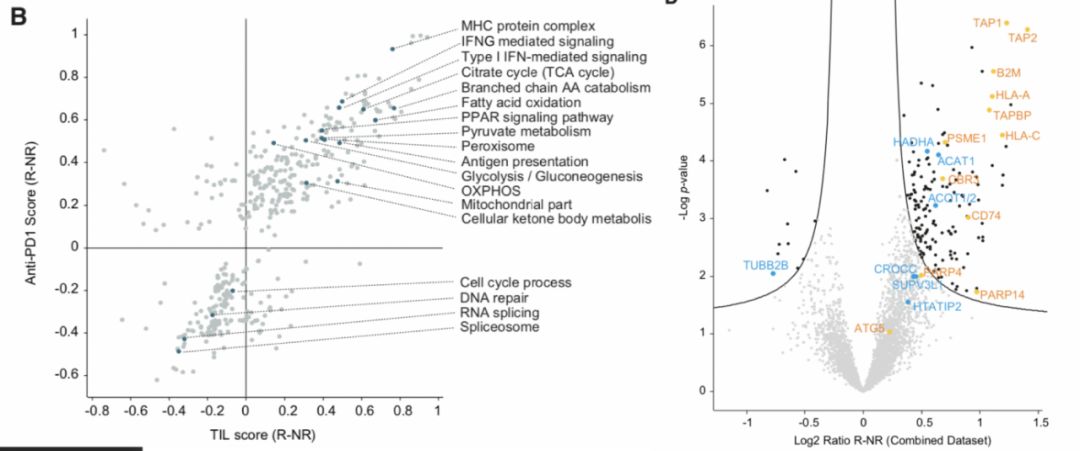
作者在后续的研究中,关注于ACAT1、ACOT1和HADHA几个高度富集的参与线粒体能量代谢的蛋白。作者首先使用组化的方式验证了这些蛋白确实在对于免疫治疗不敏感的病人的黑色素瘤的细胞中低表达。而且这些蛋白的表达水平与组织中的免疫细胞浸润具有明显的相关性。作者进一步在细胞中敲除分别ACAT1、HADHA和CPT1A,作者发现,敲除这些基因后,线粒体代谢速率都会有一定程度的降低,同样的,关键的抗原呈递相关蛋白,包括PSMB8, PSMB9,ERAP1, TAP1, TAP2, TAPBP, B2M和PD1A3等在这些基因敲除的细胞系中都显著降低,T细胞对其的杀伤作用也显著被抑制。另外,作者证明了敲除Acat1 基因后的小鼠黑色素瘤细胞系在小鼠体内的成瘤性显著增强,肿瘤内的抗原呈递关键蛋白也显著降低,T细胞的浸润也明显减少,证明了线粒体能量代谢对于黑色素瘤对于免疫治疗敏感性调节的重要作用。
这篇文章中,作者从重大的临床问题出发,通过基于高精度质谱的蛋白质组学方式,找到了黑色素瘤耐受免疫治疗的可能原因。筛选出来了一些潜在的全新的抗肿瘤治疗或者联合治疗的靶点,对于后续相关治疗手段的开发具有重要的意义。
原文链接:
https://doi.org/10.1016/j.cell.2019.08.012
参考文献
1. Wang, J., et al., Siglec-15 as an immune suppressor andpotential target for normalization cancer immunotherapy. Nat Med, 2019. 25(4): p. 656-666.
2. Wang,J., et al., Fibrinogen-like Protein 1 Isa Major Immune Inhibitory Ligand of LAG-3. Cell, 2019. 176(1-2): p. 334-347.e12.
3. Sanmamed,M.F. and L. Chen, A Paradigm Shift inCancer Immunotherapy: From Enhancement to Normalization. Cell, 2018. 175(2): p. 313-326.
4. Sharma,P., et al., Primary, Adaptive, and AcquiredResistance to Cancer Immunotherapy. Cell, 2017. 168(4): p. 707-723.
5. Pan,D., et al., A major chromatin regulatordetermines resistance of tumor cells to T cell-mediated killing. Science,2018. 359(6377): p. 770-775.
6. Ishizuka,J.J., et al., Loss of ADAR1 in tumoursovercomes resistance to immune checkpoint blockade. Nature, 2019. 565(7737): p. 43-48.
7 Liu,H., et al., Tumor-derived IFN triggerschronic pathway agonism and sensitivity to ADAR loss. Nat Med, 2019. 25(1): p. 95-102.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475706&idx=3&sn=ddf736117069a635b885cf572d2d7b74&chksm=84e2028eb3958b98db2498219c7bbee325c61dfc94e3c63cd89e473269be3ab87c3b3d46a26d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
健康 黑色素瘤 线粒体 cell 能量代谢 蛋白质组学 肿瘤免疫治疗
Nat Cancer:新技术预测黑色素瘤的扩散

诱导色素沉着能防小鼠黑色素瘤
石远凯的面对面视频

Cell:蛋白质组学揭示黑色素瘤响应免疫治疗的线粒体依赖性
美研发出黑色素介质疗法,有望根治黑色素瘤


趣味科学:仰卧起坐会导致瘫痪,这是真的吗?
新评估方法专“盯”黑色素瘤
纳米载体精准送药杀灭黑色素瘤
上海药物所等发现靶向抑制PRMT1可调控CD8+T细胞抗肿瘤免疫克服黑色素瘤免疫治疗耐药

多吃鱼可能增加患黑色素瘤风险