科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-01
来源:生物通
加州大学旧金山分校的研究人员近日利用CRISPR干扰(CRISPRi)功能基因组学平台系统鉴定了KARS G12C抑制剂与靶点的遗传相互作用,并发现了可增强抑制剂功效的组合疗法,有望防止耐药性的出现。
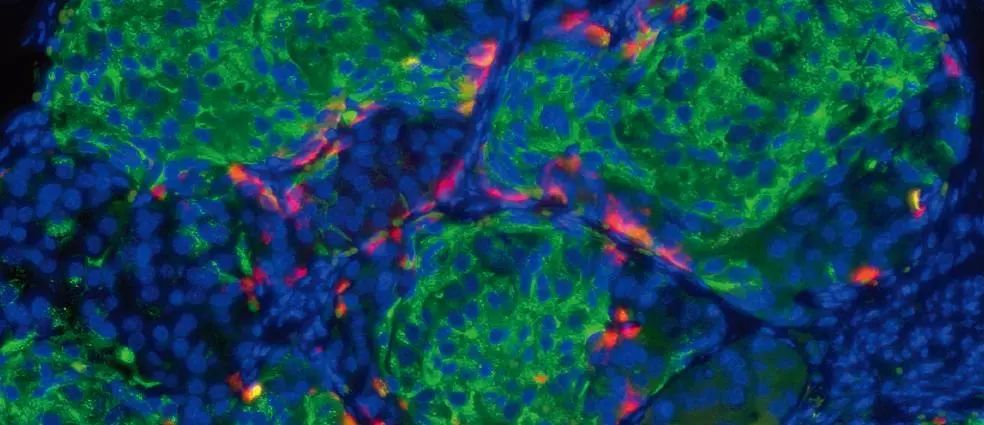
许多癌症的生长是由KRAS基因的突变引起的。尽管KRAS蛋白被认为是不可成药的,但一些新型的化合物(包括ARS-1620)能够结合并抑制特定KRAS突变体(G12C),在临床试验中表现出希望。
加州大学旧金山分校的研究人员近日利用CRISPR干扰(CRISPRi)功能基因组学平台系统鉴定了KARS G12C抑制剂与靶点的遗传相互作用,并发现了可增强抑制剂功效的组合疗法,有望防止耐药性的出现。这项成果发表在《Science Signaling》杂志上。
靶向KRAS G12C的抑制剂是一种大有潜力的癌症靶向治疗药物。当KRAS蛋白处于非活性状态时,突变蛋白上产生一个浅口袋。抑制剂以此口袋作为结合位点,与突变体半胱氨酸残基发生反应。然而,癌症可不是一般的聪明,在癌症驱动基因受到限制后,它们可能会寻找“备胎”,将之前的非必需基因变成必需基因。
研究人员表示:“这些必需基因的丧失增强了细胞对KRAS G12C抑制的敏感性。我们将这些基因称为‘旁系依赖性’(CD),并确定了两类靶向这些CD的组合疗法,它们能够增加KRAS G12C靶点的参与度,或阻断体内残留的存活通路。”
在临床前研究中,一种名为ARS-1620的抑制剂对KRAS G12C突变肿瘤表现出特异的抗癌活性,并且在小鼠中没有观察到剂量限制毒性。不过,研究人员表示,依赖KRAS G12C的癌细胞可能会召集之前非必需的基因和通路来维持生存和增殖。
他们假设,这种可维持癌细胞存活的旁系信号通路可能与合成致死(SL)依赖性不同,并将其称为旁系依赖性(CD)。利用全基因组的CRISPRi功能基因组筛选平台,他们对含有KRAS G12C突变的肺癌和胰腺癌细胞模型进行分析,确定了癌基因失活后CD影响癌细胞生长的不同机制。
“这种方法确定了RAS信号通路已知成分的特殊作用,并突出了参与转录调控的CD以及核心RAS通路以外的其他细胞过程,”作者们写道。“对于KRAS G12C驱动的许多种癌细胞,我们鉴定出的绝大多数CD都不是SL,因此证明CD在生物学上与SL不同。”
研究人员随后利用药理学来分析治疗上可靶向的CD,发现一些RAS通路基因的抑制可导致KRAS G12C的抑制。在研究这些药物相互作用的机制时,他们进一步发现这些组合疗法要么与口袋抑制直接配合,增加KRAS G12C靶点的参与,要么独立阻断残留的存活通路。
“我们检测的这两类组合疗法最终实现了常见信号节点的深度抑制,强调了致癌RAS信号网络的融合性质,”作者们写道。“我们的研究发现了在急性抑制KRAS G12C后,旁系的促癌信号蛋白通过何种机制维持突变KRAS依赖的癌症表型。”
“过去认为单个癌基因的活性可驱动癌症表型,如今这个概念正在被修订,因为靶向疗法未能达到促进持久应答和治疗患者的承诺,”他们总结道。“我们认为CD是基本细胞过程,参与了癌症驱动基因的抑制,并限制了靶向疗法的功效。”
参考文献:
KRASG12C inhibition produces a driver-limited state revealing collateral dependencies
来源:gh_c1fce5726992 生物通
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675530812&idx=7&sn=968428f933097783c104223a3f47b0e3&chksm=bc51f5ad8b267cbb6a0780b2665d91ee595790f67a1358beb8dd825ea8afb836d04d6915452f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Nature癌症新名词:癌症代谢成瘾

【癌症知多少】癌症为什么会复发?

《自然-癌症》| 癌症患者更易感COVID-19?
第22届全国肿瘤防治宣传周启动仪式在北京举行



【癌症知多少】怎样预防常见癌症?

【世界癌症日专题】——营养与癌症
哈佛大学医学院Kucherlapati教授访问中国抗癌协会



临床癌症基因组学 |《自然-癌症》专题

邓大君教授 |《世界癌症报告》2020版问世 ——调整癌症预防对策,适应癌症流行新趋势

【癌症知多少】癌症的发生竟然与性格有关,你是“癌症性格”吗?