科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-21
来源:BioArt
弥漫性大B细胞淋巴瘤(DLBCLs)是最常见的一类淋巴瘤,代表了由不同免疫系统过程引起的异质性疾病。根据基因表达谱将DLBCLs分为两个主要亚型:生发中心B细胞(GCB)和活化B细胞(ABC)两种DLBCLs。GCB-DLBCLs具有生发中心反应中B细胞的转录特征。生发中心(GCs)是在T细胞依赖性抗原反应中短暂形成的,由快速增殖的B细胞组成,B细胞在其中进行免疫球蛋白体细胞突变(SHM)。转移到富含T细胞的L区后,表达高亲和力的免疫球蛋白的GCB分化成浆细胞(PC)。ABC-DLBCLs具有“post-GC”转录特征,且慢性活化的BCR信号和NF-κB激活与BCR和TLR信号通路的体细胞突变有关。目前,ABC-DLBCLs的细胞起源及其恶性转化机制尚不清楚。
近期两项独立研究根据基因定义了一种新的ABC-DLBCLs亚型(MCD),具有MYD88、CD79B的体细胞激活突变型和TBL1XR1的复发性突变型,与不良的临床结果有关。根据变异等位基因频率推测,TBL1XR1可能是起始突变。临床和生物学特征显示,这种淋巴瘤具有不寻常的结外分布特征,可侵袭中枢神经系统和睾丸,且GCB和PC并不归巢到这些组织,那么在复杂的免疫系统环境中这些肿瘤的发病机制和起源如何,还有待进一步研究。
TBL1XR1的先天性错义突变与儿童早期发展性精神障碍有关,如Pierpont综合症,提示TBL1XR1具有广泛的生物学相关性。TBL1XR1是SMRT/NCOR1转录抑制复合物的核心组分,且SMRT/NCOR1复合物中含有HDAC3,能够抑制转录。目前对于TBL1XR1确切作用的描述,主要是:1)增强复合物的功能;2)推动复合物的分解。值得注意的是,在GCB中,大多数SMRT/NCOR1复合物被转录抑制子BCL6结合和招募,这对GC的形成至关重要【3】。实际上,DLBCL的大多数复发性突变直接或间接地增强了BCL6的功能,驱动肿瘤生存。而TBL1XR1的突变可能会影响SMRT/NCOR1复合物和BCL6,或导致极为有趣的表型,目前缺乏对此的研究。
近日,来自美国康奈尔大学的Ari M. Melnick在Cell杂志上发表文章TBL1XR1 Mutations Drive Extranodal Lymphoma by Inducing a Pro-tumorigenic Memory Fate,发现TBL1XR1突变导致体液免疫偏向于产生异常的未成熟记忆B细胞(MB),同时损伤浆细胞的分化。TBL1XR1突变体与SMRT/HDAC3抑制复合物协同优先结合到MB细胞转录因子BACH2,同时剔除掉生发中心转录因子BCL6的结合,导致pre-MB转录过程重编程和细胞分化偏差。一旦抗原再次出现,TBL1XR1突变的MB细胞不能分化成浆细胞,而是优先进行新的GC反应。最终,TBL1XR1突变导致极其类似于人类ABC-DLBCLs的结外免疫母细胞淋巴瘤表型。
 DLBCL和滤泡性淋巴瘤(FL)病例中,TBL1XR1体细胞突变发生率为5~10%,主要表现为杂合子错义等位突变。TBL1XR1突变在ABC-DLBCL中发生更为频繁,主要发生在WD40结构域,影响桶形结构表面的芳香残基,而这些残基被预测可介导蛋白质相互作用。研究人员构建了GC或Post-GC B细胞中特异性TBL1XR1失活突变小鼠Tbl1xr1D370Y/WT,GC反应中Tbl1xr1D370Y/WT小鼠的B细胞丰度没有改变,但GCB的绝对数目和比例显著下降,且小鼠的脾脏结构没有被破坏。免疫组化染色显示,D370Y/WT小鼠的滤泡结构正常,GCs较少,但脾脏的GC数量不变。进一步研究显示,D370Y/WT小鼠的GC反应被破坏,GCB细胞的丰度在整个GC反应中显著降低,但GCB的动态变化过程没有被影响。TBL1XR1突变小鼠中GCB细胞的凋亡没有改变,而增殖被损伤,G0-1期的GCB显著增多,而S期和G2/M期则相应地减少,这或是GCB细胞减少的原因。
DLBCL和滤泡性淋巴瘤(FL)病例中,TBL1XR1体细胞突变发生率为5~10%,主要表现为杂合子错义等位突变。TBL1XR1突变在ABC-DLBCL中发生更为频繁,主要发生在WD40结构域,影响桶形结构表面的芳香残基,而这些残基被预测可介导蛋白质相互作用。研究人员构建了GC或Post-GC B细胞中特异性TBL1XR1失活突变小鼠Tbl1xr1D370Y/WT,GC反应中Tbl1xr1D370Y/WT小鼠的B细胞丰度没有改变,但GCB的绝对数目和比例显著下降,且小鼠的脾脏结构没有被破坏。免疫组化染色显示,D370Y/WT小鼠的滤泡结构正常,GCs较少,但脾脏的GC数量不变。进一步研究显示,D370Y/WT小鼠的GC反应被破坏,GCB细胞的丰度在整个GC反应中显著降低,但GCB的动态变化过程没有被影响。TBL1XR1突变小鼠中GCB细胞的凋亡没有改变,而增殖被损伤,G0-1期的GCB显著增多,而S期和G2/M期则相应地减少,这或是GCB细胞减少的原因。
对D370Y/WT的GCB进行RNA-seq分析,显示GCB中BCL6-SMRT抑制ABC -DLBCL相关信号、趋化因子、免疫细胞因子和NF-κB等信号通路,而TBL1XR1突变上调相关通路基因,更倾向于基因表达去抑制化。表明TBL1XR1在支持BCL6-SMRT复合物的功能上具有重要作用。GC反应中,TBL1XR1突变小鼠的pre-MB细胞显著增加,阻断IL-9R功能可部分逆转preMB的增加和GCB的降低。增加的Pre-MB更倾向于分化成MB细胞而不是PC细胞,这与D370Y/WT GCB细胞具有显著富集的记忆性B细胞(MB)的基因特征,而不具有浆细胞(PC)的基因特征相一致。TBL1XR1突变MB的类型转换(class-switch recombination,CSR)过程被抑制,导致IgM+相对增加,IgG1+细胞减少。当再次免疫时,TBL1XR1突变导致持续性的MB异常扩张,而不能形成抗原特性PC细胞。这也是首次证明淋巴瘤突变可以促使假定的克隆前体细胞优先进入随后的免疫反应中,而跳过前面的免疫过程。
机制上,TBL1XR1野生型主要与SMRT/HDAC3复合物、BCL6和BACH2相互作用。在TBL1XR1突变细胞中,TBL1XR1突变体与BACH2-SMRT/HDAC3的相互作用增加了6倍,而与BCL6的作用没有变化,这与BCL6抑制的基因在TBL1XR1突变GCB中去抑制化相一致。这说明GCB中,TBL1XR1对SMRT与BCL6的优先结合非常重要,TBL1XR1失活突变导致其优先于BACH2互作,导致GC受损和MB细胞命运偏差。
最后,研究人员发现免疫小鼠产生GC反应,TBL1XR1突变小鼠产生的肿瘤大多数位于淋巴结外,比如肾脏、肺、肝脏和小肠,且表现出更严重的脾脏增生,脾脏中GCB数量降低,B220-细胞扩增,pre-MB群扩张。TBL1XR1突变小鼠的淋巴组织和其他组织中主要是较大的高度非典型的免疫母细胞,通常具有大而不规则的细胞核和中等含量的细胞质,与人类结外ABC-DLBCLs相似。小鼠脾脏中,这些细胞主要出现在红髓滤泡外,破坏脾脏结构,广泛浸润和扭曲肝脏和肾脏等组织。相比于野生型小鼠,TBL1XR1突变小鼠的免疫后死亡率更高,死亡时间更早。人类DLBCL样本中,GCB和PC的标志物CD38在40%的TBL1XR1WT DLBCLs中出现,而仅在10%的TBL1XR1MUT出现。利用CyTOF对DLBCL病人样本中B细胞进行分群,发现携带了TBL1XR1和MCD/C5典型突变的ABC-DLBCL肿瘤中B细胞群仅展现出MB细胞的表面标志物。即TBL1XR1失活突变导致MB细胞异常扩增,增强了重新进入GC反应的倾向,最终导致具有MB样特征的post-GC结外ABC-DLBCL,揭示出ABC-DLBCL肿瘤自然产生于体液免疫的机制。
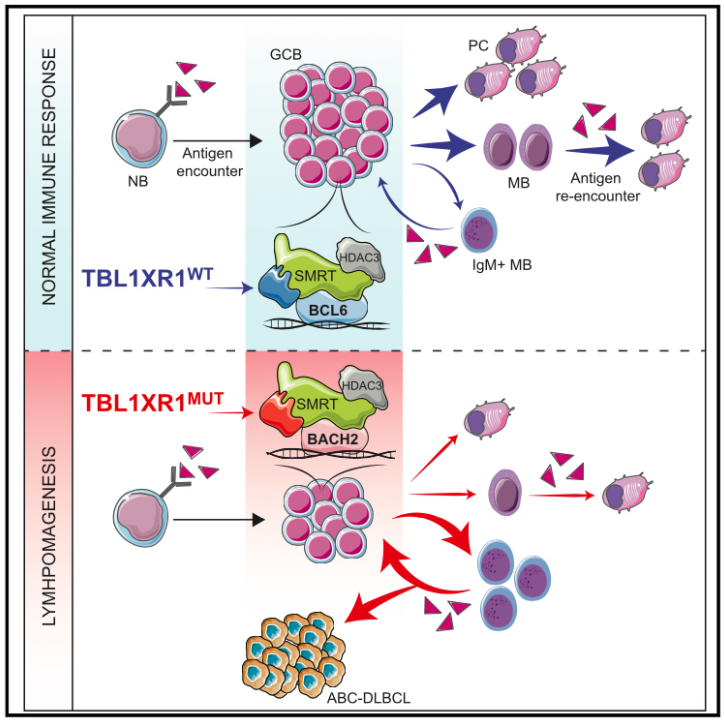
总的来说,研究揭示出TBL1XR1失活突变导致体液免疫偏向于产生未成熟的MB,损伤PC细胞分化;再次免疫时优先进行新的GC反应,最终导致极其类似于人类ABC-DLBCLs的结外免疫母细胞淋巴瘤表型。证明了ABC-DLBCLs的肿瘤起源和免疫系统恶性转化的机制,为研究ABC-DLBCLs提供了新的视角。
参考文献
1. Phelan, J.D., Young, R.M., Webster, D.E., Roulland, S., Wright, G.W., Kasbe- kar, M., Shaffer, A.L., 3rd, Ceribelli, M., Wang, J.Q., Schmitz, R., et al. (2018). A multiprotein supercomplex controlling oncogenic signalling in lymphoma. Nature 560, 387–391.
2. Chapuy, B., Stewart, C., Dunford, A.J., Kim, J., Kamburov, A., Redd, R.A., Lawrence, M.S., Roemer, M.G.M., Li, A.J., Ziepert, M., et al. (2018). Molecular subtypes of diffuse large B cell lymphoma are associated with distinct patho- genic mechanisms and outcomes. Nat. Med. 24, 679–690.
3. Hatzi, K., Jiang, Y., Huang, C., Garrett-Bakelman, F., Gearhart, M.D., Gianno- poulou, E.G., Zumbo, P., Kirouac, K., Bhaskara, S., Polo, J.M., et al. (2013). A hybrid mechanism of action for BCL6 in B cells defined by formation of func- tionally distinct complexes at enhancers and promoters. Cell Rep. 4, 578–588.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652500127&idx=5&sn=45097783353c030c70a7a22ab925cadd&chksm=84e2632bb395ea3d10a1cf8125d1ef8755f6a036ae2ea5cb035a8fe6e7f81164fb49766ae4a5#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

霍奇金淋巴瘤和侵入性非霍奇金淋巴瘤方案制定借助CT好还是PET/CT好?
王陈继团队揭示SPOP-MyD88通路基因突变在弥漫性大B细胞淋巴瘤中的作用机制

【防癌早知道】淋巴瘤的病因是什么?

新基因疗法成功挽救淋巴瘤患者

【科普】万恶的“淋巴瘤”
弥漫大B细胞淋巴瘤替代终点研究成果荣登血液肿瘤学顶级期刊《Leukemia》

针对复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)

【防癌早知道】淋巴瘤会传染吗?

国产生物类似药实现零的突破 淋巴瘤患者迎来新药
美国科学家重新分类弥漫性大B细胞淋巴瘤