科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-10
来源:BioArt植物
原标题:Trends in Plant Science | 新机遇新挑战——基因调控网络在作物遗传改良中的应用
今年4月,由联合国粮农组织、联合国粮食计划署和欧盟共同发布的《全球粮食危机报告》显示,2018年,全球53个国家的1.13亿人面临重度粮食不安全状况,而2017年这一数字为1.24亿。尽管已整体取得进展,但各区域间仍存在巨大差异。受影响的国家数量有所增加,并且有17个国家国内的重度饥饿人数保持不变或出现了上升。欧盟人道主义援助和危机管理委员Christos Stylianides表示,“粮食危机将持续构成一项全球挑战,需要我们共同加以应对”【1】。
随着全球人口的快速增加,粮食缺口问题将愈发严峻。在全球可开坑荒地日趋枯竭的大背景下,通过作物遗传改良持续提高农作物单产,成为解决全球粮食危机的重要手段。传统的以田间选择为主的育种方法基本上是对表型进行直接选择,因此常常又被称为“经验育种”,一般存在周期长、效率低等缺点【2】。随着高通量测序技术的迅猛发展和测序成本的持续降低,以分子标记育种、转基因育种、分子设计育种为代表的现代作物分子育种技术逐渐成为了全世界作物育种的主流,在我国也正在成为作物遗传改良的重要手段。作为一种把表型和基因型选择结合起来的作物遗传改良理论和方法体系, 分子育种能大幅度提高育种效率,缩短育种年限,实现“精确育种”。
近日,Trends in Plant Science杂志在线发表了美国明尼苏达大学题为“ Challenges of Translating Gene Regulatory Information into Agronomic Improvements”的文章,阐述了基于高通量测序技术的转录因子/靶基因互作网络鉴定以及遗传变异在作物改良中的作用。
利用遗传变异产生的复杂数量性状,包括高产,优质和抗病虫等优良性状,极大的推动了农作物的改良进程。大部分的功能变异都受到顺式调控元件(cis-regulatory elements)和反式作用因子(trans-acting factors)的调控,并最终导致基因表达差异。鉴定基因表达调控网络对于增加农作物产量和适应性具有重要作用,然而,在挖掘优良性状关联基因的进程中依然存在着巨大的挑战。
基因表达调控贯穿植物生长发育的各个阶段,其核心是转录因子(transcription factors ,TFs)通过招募、互作或调整转录机制的成分,以实现激活或抑制特定靶基因的转录【3】。不同家族的转录因子能够通过蛋白互作形成种类多样的复合物,从而调控靶基因特定的时空表达模式。转录因子可以调控另外一个转录因子的表达,也能够调控结构蛋白或代谢酶编码基因的表达,进而控制重要的农艺性状【4】。基因在何时何处表达,依赖于调控区域的顺式调控元件及结合在元件上的单个转录因子或复合物(图1)。
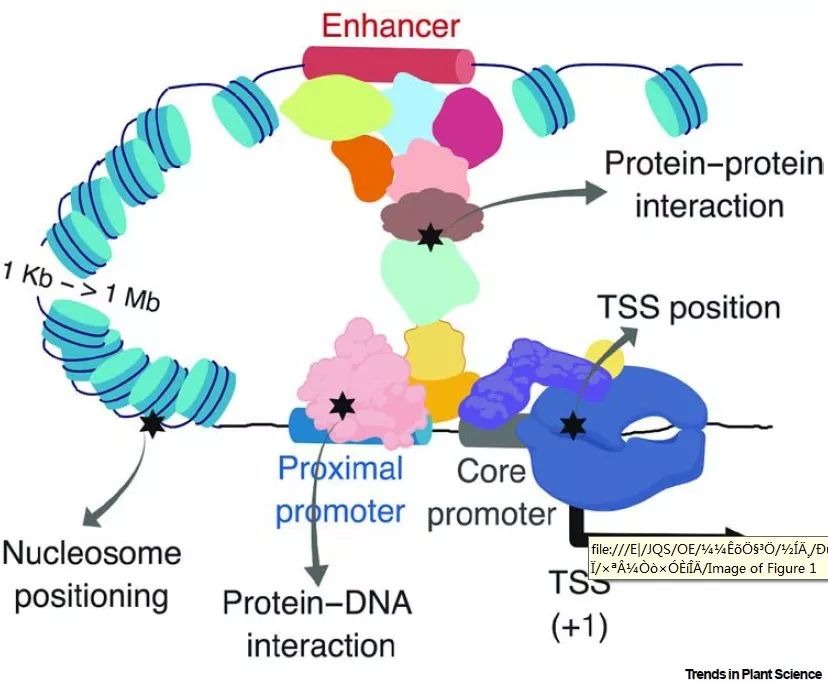
图1 遗传变异通过影响转录起始复合物调控基因表达模式
对动植物而言,遗传变异相对于RNA自身的丰度,对基因转录具有更重要的影响。基因转录的核心是基因调控网络(gene regulatory networks,GRNs),其描绘了生物体中所有基因表达所必需的蛋白-蛋白和蛋白-DNA相互作用网络(PDIs)。
因此,研究GRNs的一个关键步骤是确定PDIs所涉及的转录因子及其靶基因,主要方法包括方法以转录因子为中心的方法和以基因为中心的方法(图2)【5】。以转录因子为中心的方法包括染色质免疫共沉淀(ChIP)和DNA亲和纯化(DAP)。
并且当把二者联用时,能够鉴定到数千个潜在的转录因子靶基因。以基因为中心的方法,如酵母单杂交(Yeast One-Hybird, Y1H),能够鉴定到结合在基因启动子特定区域的转录因子。酵母单杂交已成功用于拟南芥根部发育、细胞壁合成、细胞重编程以及玉米酚类化合物调控等研究方向的互作网络鉴定【6,7,8,9】。
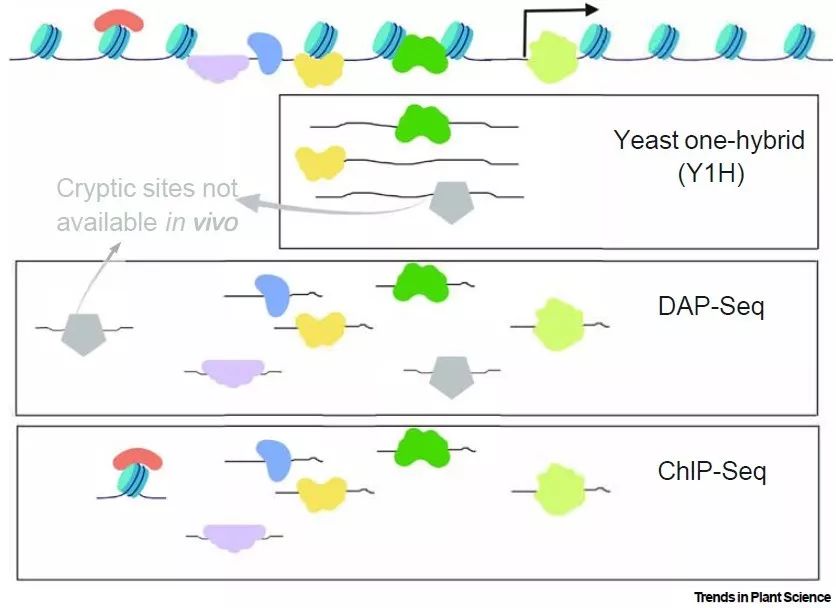
图2 蛋白-DNA互作研究方法
对于农林研究领域而言,由于抗体的缺乏,免疫沉淀法(IP)无法得到大规模的应用。因而,研究蛋白-蛋白/蛋白-DNA互作的最主要方法是酵母双杂交和酵母单杂交【10,11】。但是传统的酵母单/双杂交过分依赖从组织样本获取的总cDNA文库,里面包含了大量的特异表达基因和非靶标基因。与总cDNA文库相比,使用均一化的转录因子文库,能够显著提高互作鉴定的阳性率【12,13】。
据报道,已有多个生命科学领域顶级实验室构建了转录因子文库,在性状基因筛选和调控网络构建方面取得了重大研究进展。早在2011年,北京大学科研团队即构建了拟南芥转录因子文库,并且发展了一套基于mating的酵母单杂/双杂高效筛选方法。
利用该文库成功地对已报道的NPRI-TGA蛋白-蛋白互作和CHE-CCA1蛋白-DNA互作关系进行了验证,证明了拟南芥转录因子文库的可用性。2017年,俄亥俄州立大学Erich Grotewold实验室构建了包含1901个基因的玉米转录因子文库,并利用54个酚类合成相关基因的启动子进行酵母单杂筛库,一共鉴定到与568个转录因子之间的1100个蛋白-DNA互作关系,显示出高效的筛选效率【14】。
但是,由于转录因子数量巨大,再加之多数禾本科作物基因组GC含量较高,结构复杂,通过PCR方法克隆基因难度大,导致大多数实验室没有经费和精力独立构建转录因子文库,极大的限制了转录调控网络研究的发展。因此,商业化转录因子文库及相关科研服务的推出,势在必行。
目前,已经在进行商业化推广的转录因子文库包括拟南芥和水稻全长转录因子酵母文库(点击查看案例)。据悉,这两个转录因子文库分别与北京大学,中科院遗传发育所科研团队联合研发,历时5年时间精心打造,分别包含近1600个已报道的转录因子,相关序列信息可以在TAIR,ABRC,PlantTFDB和PlnTFDB等权威数据库查询。基于该拟南芥转录因子文库进行的互作蛋白筛选工作,研究成果已发表于植物科学顶级期刊《Molecular Plant》【15】。而水稻转录因子文库更是科研领域为数不多的模式作物转录因子文库之一。拟南芥/水稻转录因子文库相比于普通酵母文库,具有以下特点和优势:
构建采用传统PCR克隆方法,耗资巨大,确保获得拟南芥/水稻转录因子全长CDS序列。
原始克隆载体从ABRC,FAIS,RIKEN,NIAS等科研机构获得,确保数据权威。
转入酵母表达菌株Y187,适用酵母单杂交和双杂交筛选。
酵母筛库流程优化,一对一筛库,无需再次验证。
配合量身打造的全新自动化工作站Yeast Transformation Workstation,确保酵母单/双杂交实验的准确性和高效性。
另外,除了能服务拟南芥/水稻相关科研任务,转录因子文库同样适用于其他物种来源的诱饵蛋白/基因的互作筛选。因为转录因子在生物间具有一定的保守性,不同物种的同一转录因子家族的转录因子具有同样或者类似的结合序列。有研究表明,利用水稻HAF1(288a.a-667a.a)蛋白为诱饵,筛选拟南芥转录因子文库。得到互作蛋白后,通过同源性比对获得水稻中候选互作蛋白,进一步证明的确与HAF1 互作存在关系【16】。据悉,相关科研服务平台也在同步测试不同物种来源的诱饵蛋白筛选拟南芥/水稻转录因子文库,如果您也有相同需求,可以联系平台进行科研合作。
小编期待,拟南芥/水稻全长转录因子酵母文库的推出,能够助力广大科研工作者快速构建基因表达调控网络,为作物遗传改良增添新动力。
欧易生物的拟南芥/水稻全长转录因子酵母文库服务已日渐成熟,想了解详情的研究人员了可点击下图或阅读原文了解详情。
参考文献
[1]Global Report on Food Crises 2019.Food and Agriculture Organization of the United Nations.
[2] Stuber C W, Polacco M, Senior M L. Synergy of empiricalbreeding, marker-assisted selection, and genomics to increasecrop yield potential. Crop Sci, 1999, 39: 15711583
[3] Spitz, F. and Furlong, E.E.M. (2012) Transcription factors: fromenhancerbinding to developmental control. Nat. Rev. Genet. 13, 613
[4] Brkljacic, J. and Grotewold, E. (2017) Combinatorial control ofplant gene expression. Biochim. Biophys. Acta Gene Regul.Mech. 1860, 31–40
[5]Yang, F. et al. (2016) Establishing the architecture of plant generegulatory networks. Methods Enzymol. 576, 251–304
[6]Brady, S.M. et al. (2011) A stele-enriched gene regulatory networkin the Arabidopsis root. Mol. Syst. Biol. 7, 459
[7]Taylor-Teeples, M. et al. (2015) An Arabidopsis gene regulatorynetwork for secondary cell wall synthesis. Nature 517, 571–575
[8]Ikeuchi, M. et al. (2018) A gene regulatory network for cellularreprogramming in plant regeneration. Plant Cell Physiol. 59,770–782
[9]Yang, F. et al. (2017) A maize gene regulatory network for phenolicmetabolism. Mol. Plant 10, 498–515
[10]Fields, S., and Song, O.-k (1989). A novel genetic system to detectprotein–protein interactions. Nature. 340, 245–246.
[11]Li, J.J., and Herskowitz, I. (1993). Isolation of ORC6, a component ofthe yeast origin recognition complex by a one-hybrid system. Science.262, 1870–1874.
[12]Deplancke, B. et al. (2006) A gene-centered C. elegans protein-DNA interaction network. Cell 125, 1193–1205
[13]Mitsuda, N. et al. (2010) Efficient yeast one-/two-hybrid screeningusing a library composed only of transcription factors inArabidopsis thaliana. Plant Cell Physiol. 51, 2145–2151
[14] Pruneda-Paz, J. L., Breton, G., Nagel, D. H., Kang, S. E., Bonaldi, K., Doherty, C. J., … Kay, S. A. (2014). A genome-scale resource for the functional characterization of Arabidopsis transcription factors. Cell reports, 8(2), 622–632. doi:10.1016/j.celrep.2014.06.033
[15] Ou, B., Yin, K.Q., Liu, S.N., Yang, Y., Gu, T., Wing Hui, J.M., Zhang, L., Miao, J., Kondou, Y., Matsui, M., et al. (2011). A high-throughput screening system for Arabidopsis transcription factors and its application to Med25-dependent transcriptional regulation. Mol. Plant 4, 546–555
[16]何贻洲. 水稻抽穗期基因的克隆及HAF1互作蛋白的筛选[D].
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247492560&idx=2&sn=3063a84a7c52c694148bc8cc78405300&chksm=fd7379b7ca04f0a15fc375fd2e6887eea5131221362d4056c117163b08ad7ebaf7a6d4ad5ab6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

水稻二萜植保素momilactone 合成通路及基因簇的进化研究取得进展
BioLABs protoco:酵母双杂交技术原理及实验步骤

科技话题:水稻抗稻瘟病新机制、新型亚稳结构、胆固醇合成调控新机制、首个深空天线组阵系统、鸟基因组图谱、新基因编辑工具诞生

杭州师范大学于彦春与合作者揭示脂肪酸合成相关基因HTS1调控水稻耐热性的分子机制
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知

何祖华:和稻瘟病较劲15年

萜类合成基因在防御松材线虫中起正调控作用

酵母双杂交常见问题解析--Coolaber敬献
【微话题】今日科技话题:水稻抗稻瘟病新机制、新型亚稳结构、胆固醇合成调控新机制、深空天线组阵系统、鸟基因组图谱、新基因编辑工具

JIPB:系统总结了水稻和拟南芥中乙烯信号转导途径的新调控组分和新机制