科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-25
来源:植物科学最前沿
酵母
Coolaber
酵母双杂交常见问题解析--Coolaber敬献
1. 灭菌后酵母培养基颜色变成棕褐色。
SD系列的培养基预混了葡萄糖,在灭菌过程中由于灭菌时间较长,或者灭菌后在高温条件下长时间放置,引起培养基中葡萄糖碳化,导致颜色变深。通常情况下,对酵母培养不会产生较大影响(对个别毕赤酵母菌种影响较大),可以通过控制灭菌时间和灭菌温度来减少碳化程度,如118℃灭菌15分钟,并及时倒板。另外Coolaber产品中SC系列酵母培养基,不包含葡萄糖,需要将过滤除菌的葡萄糖加入灭菌后酵母培养基中,这种方法配制的培养基,显示透明偏白色。
2. 酵母培养基不凝胶,或者凝胶硬度不够。
调整酵母筛选培养基的pH(5.8); 适当增加琼脂(建议量20g/L)。2019年后Coolaber公司出品的酵母培养基,只需要加入适量的去离子水,无需调pH,直接灭菌即可。
3. 培养过程中酵母细胞变成粉色的可能原因。
培养基中腺嘌呤(Ade)浓度低;或酵母细胞代谢途径产生问题。一般通过往培养基中补加硫酸腺嘌呤(60mg/L)来改善这一情况。Coolaber所有酵母培养基均加入足够的腺嘌呤。实际操作中,酵母变粉色也并不影响蛋白间的相互作用。
4. 酵母细胞生长较慢。
可能原因:酵母表达的诱饵蛋白对细胞有毒害作用,影响酵母生长。
解决办法:可通过选择低敏感性的酵母菌株;或选用低拷贝数的表达载体。
5. 诱饵蛋白对酵母细胞是有毒的,该怎样进行后续实验?
在液体培养基中培养不好的菌株可以在固体培养基上生长得很好。首先重悬克隆于1ml的SD/–Trp(PM2251),接着将重悬液平铺于5 个100mm的SD/–Trp平板(PM2252),在30℃下温浴,直至平板上的克隆相互连在一起。用5ml 0.5X YPDA(PM2011)刮下每块板上的克隆,并收集到一管中,这样就可以使用这个细胞重悬液进行正常的杂交反应。
6. 筛选培养基上克隆太多。
可能原因:可能诱饵蛋白存在自激活,自身就可以激活下游筛选标记的表达;或者是筛选条件过于宽松。
解决办法:选用更为严格的筛选条件抑制诱饵蛋白的自激活活性,如果效果不理想,可以删除诱饵蛋白能够引起自激活活性的结构域,再用于酵母双杂交实验。
7. 筛选培养基上克隆太少。
可能原因:酵母杂交效率低;或筛选条件太严格
解决办法:延长杂交时间,提高杂交效率;放宽筛选条件。
8. 酵母质粒提取比较繁琐,有没有好的替代方法?
Coolaber出品的酵母阳性克隆快速鉴定试剂盒(SK2420)仅仅需要高温加热酶解酵母菌3-5分钟就可以获取酵母质粒粗提物,完全可以用于PCR验证。
9. 获得的阳性克隆,PCR检测有多条片段。
可能原因:一个酵母细胞可以包含多个捕获蛋白。
解决办法:选取单克隆划板2-3次,进行蓝白斑筛选,直到没有分离,找到阳性克隆,用于后续实验。
10.X-α-gal是否只可以用DMF溶解?
几乎所有酵母杂交的实验中,均使用DMF溶解X-α-gal。X-α-gal也溶解于甲醇和DMSO。经过验证酵母杂交的实验中DMSO可以用于X-α-gal的配制与稀释。但DMSO熔点高,使用不便。甲醇还未经验证。
11.杂交效率不高,怎么办?
效率不高,可能是杂交细胞数量不够,适当增加诱饵蛋白的液体培养量,保证有足够的细胞数量。可以延长杂交时间,直至通过显微镜镜检观察到存在三叶草形状的合子产生,再进行后续操作。
12.为了验证两个蛋白间的相互作用共转时把AD转到带有BD的Y2HGold,还是BD、AD一起转到Y2HGold?
两种方法都可以,如果是AD转到带有BD的Y2H Gold中,制备含有BD载体的Y2H Gold菌株的感受态时用SD/-Trp培养基摇菌。
13.酵母转化完成后可以用无菌水代替0.9%NaCl溶液重悬菌体吗?
生理盐水重悬的目的是为了维持渗透压,无菌水重悬酵母菌也可以,无菌水重悬后涂板和生理盐水重悬后涂板,转化效率并无明显差异。
14.如何降低酵母双杂交系统中出现的假阳性?
可以选择多个筛选标记进行更为严格的筛选,降低假阳性;或者通过适当提高AbA(CA2332)或3-AT(CA1311)的浓度(详见www.coolaber.com),降低假阳性。
15.诱饵蛋白是否一定需要自激活检测?
自激活检测需要在Y2H Gold菌株中进行,主要作用有两个,其一,需要根据诱饵蛋白自激活的程度调整AbA的浓度或3-AT的浓度;其二,检测诱饵蛋白是否具有毒性,如果菌落生长过慢,可能表达的蛋白具有毒性,需要使用低拷贝的质粒表达诱饵蛋白。
16.AbA浓度对酵母菌筛选有什么影响?
AbA用于筛选阳性克隆,双杂常用浓度为100-200 ng/mL 。在阴性、阳性对照正常的前提下,如筛选出来的阳性克隆数太少,将AbA浓度降至100ng/mL;如筛选出来的阳性克隆数太多,排除自激活的前提下,相应增加AbA的浓度。AbA的有效浓度也与接种量有关,如因接种量过多在含AbA的平板长出连成片的菌落,使得AbA无法达到有效作用效果。通常,抑制单杂重组酵母本底表达,需要用100 ng/mL,150 ng/mL,200ng/mL的AbA筛选约2000个细胞,如果细胞数量过多,同样AbA无法抑制本底表达。
17.3-AT的筛选浓度怎么选择,有没有建议的使用浓度范围?
理想情况 10 mM浓度的3-AT平板会有少量生长,20 mM浓度的3-AT不能或极少生长。如果在80 mM浓度的3-AT平板上生长酵母,说明自激活活性太高,不能用于双杂交筛选。
18.诱饵蛋白具有自激活活性,能够单独激活报告基因的表达怎么办?
该蛋白如果是一个转录因子,具有转录激活域,需要去掉转录激活结构域。如果不是转录因子但仍具有较强的转录激活活性,需要将诱饵蛋白具有激活活性的区域去除,进行后续操作,但这样操作有可能影响蛋白间的互作。
19.诱饵蛋白的大小是否对酵母双杂交的结果有影响?
虽然文献报道从8-750个氨基酸都有成功的案例,但是分子量比较大的蛋白由于在酵母中可能存在折叠错误的情况,在实际工作中,分子量比较大的诱饵蛋白在酵母中寻找互作蛋白的成功率低于中等大小分子量的诱饵蛋白。
20.酵母双杂交如何选择使用核体系还是膜体系文库?
如果诱饵蛋白定位在膜上,使用膜体系文库;如果诱饵蛋白定位在细胞核则选择核体系;如果诱饵蛋白具有跨膜区,可以考虑把跨膜区去除或者选用定位在胞内的区域使用核体系进行筛库,但有一定风险。
21.在酵母菌株中检测不到诱饵蛋白的表达或者表达不完全,怎么办?
可能是酵母细胞的OD值太低,细胞数量少,导致诱饵蛋白量低,很难检测到,可以增加液体培养量;另一种原因可能是诱饵蛋白包含大量的稀有密码子,酵母很难进行翻译,建议优化氨基酸序列,合成一条由酵母细胞能够识别的密码子组成的编码相同的氨基酸序列的核苷酸,有望大大提高诱饵蛋白在酵母细胞中的表达。
22.四缺板上筛选到的阳性克隆可以直接拿菌液或酵母质粒去测序吗?
不行,因为酵母质粒拷贝数低,达不到测序浓度,所以需要将抽提出的质粒转到大肠杆菌培养后再测序。
23.筛到的蛋白经测序后,为什么从AAA AAA后翻译的结果有好多都移码?
三框文库不是为了保证不移码,而是保证文库中的每个基因的克隆都至少有一种不移码,即文库表达的目的蛋白中总有正确的蛋白。所以出现移码情况,需要分析测序峰图而不单只看测序结果,也许峰图上有某个位点缺失导致序列移码,这种情况需要手动调整序列。理论上只有不移码的基因才会被筛选出来。
酵母筛选培养基,酵母转化,酵母阳性克隆鉴定,酵母质粒提取等酵母杂交实验试剂,不仅质优价廉,且无需等待。特殊筛选培养基可以定制!
来源:frontiersin 植物科学最前沿
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247493094&idx=1&sn=9f0b39c840a314e975f70d5f82ed8e9b&chksm=e8bd97f8dfca1eee42aec2f9208ba5859fd59f1d0389ee782a2666aebcecadade7d600693932&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

华南植物园“一种带菌离体植物材料组织培养基及组织培养方法”获发明专利

李继刚团队建立用于研究光敏色素与信号分子光可逆互作的LexA酵母双杂交系统
再这么配培养基,你的细菌都被毒死了!
新机遇新挑战——基因调控网络在作物遗传改良中的应用
Nature:中科院先进院发现空间扩展生境定殖的进化稳定性策略
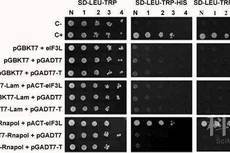
BioLABs protoco:酵母双杂交技术原理及实验步骤
半固体培养基