科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-06
来源:植物生物学
以Clontech公司的Matchmaker GAL4 Two-Hybrid System系列为例。
原理
转录因子通常含有两个独立的结构域:DNA结合域(BD)和转录激活域(AD),只有当这两种结构域共同作用时才能使转录正常进行。利用此特性,可以分别使BD与AD同“诱饵”蛋白(X)和“猎物”蛋白(Y)形成融合蛋白,一般把用来进行筛选的目的蛋白称为“诱馆”蛋白,而筛到的阳性克隆称为“猎物”蛋白。单独的BD与AD蛋白质游离于细胞中不同的位置而分开,不能激活报告基因的转录。如果两种蛋白X和Y可以发生相互作用,就能使BD与AD在空间上充分接近,从而激活报告基因的转录。
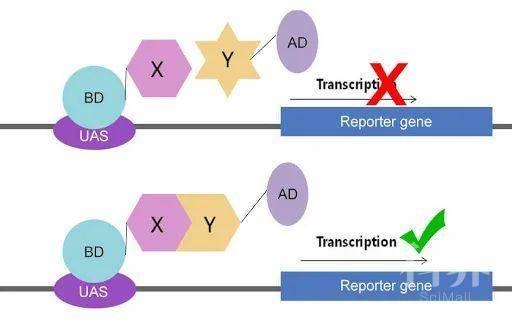
图1.酵母双杂交技术原理(图片来源于网络)
目前酵母双杂交实验采用的系统有 LexA 系统和 Gal4 系统两种。在 LexA 系统中,DNA 结合结构域由一个完整的原核蛋白 LexA 构成,转录激活结构域则由一个 88 个氨基酸的酸性的大肠杆菌多肽 B42 构成,它在酵母中可以活化基因的转录;在 Gal4 系统中,BD 和 AD 分别由 Gal4 蛋白上两个不同的结构域(1-147aa 与 768-881aa)构成。
与大肠杆菌采用抗生素筛选的策略不同,酵母系统常采用营养标记作为报告基因。常用的报告基因有 HIS3,URA3,LacZ 和 ADE2 等,对应的宿主菌则是相应标记的缺陷型细胞,必须要在含有该营养标记的培养基中生长。Gal4系统中的酵母菌种经过了基因改造后既不能产生GAL4,又不能合成亮氨酸(LEU)、色氨酸(TRP)、组氨酸(HIS)、腺嘌呤(ADE),因此,酵母在缺乏这些营养的培养基(SD-LEU-TRP-HIS-ADE,四缺)上无法正常生长。只有当有相互作用的蛋白存在时,激活报告基因的表达,从而通过功能互补,能够在不含营养标记的培养基中生长,以此验证是否存在相互作用。同样,也可以通过显色反应进一步确认是否有相互作用。
酵母双杂交的应用
(1) 检验一对已知蛋白(或结构域)间的相互作用;
(2) 用已知功能的蛋白基因筛选 cDNA 文库,寻找互作蛋白,根据钓到的基因功能推测该新基因作用网络。
酵母双杂交系统主要应用于快速验证已知蛋白之间的相互作用或寻找新的相互作用蛋白质,尤其在寻找蛋白质互作区域时相当有优势。其优点有:
(1)采用高拷贝和强启动子的表达载体使目的蛋白过量表达,方便复合物的形成;
(2)筛选过程在真核酵母活细胞内进行,一定程度上反映了体内的真实情况;
(3)检测的结果是基因表达产物的级联效应,通过mRNA产生多种稳定的酶使信号放大,因而可检测存在于蛋白质之间的微弱的或暂时的相互作用,而细胞内的免疫共沉淀依赖于两个互作蛋白质的解离程度,因为在免疫沉淀的过程中通过洗涤的过程降低了互作信号;
(4)文库来源广泛,可采用不同组织、器官、细胞类型和特殊分化时期材料构建成cDNA文库。
缺点有:目前的酵母双杂交方法存在操作复杂,假阳性和假阴性多,结果主要为定性数据,不易精确判断蛋白质相互作用的强度等问题。酵母双杂交结果需要再用其他方法进行进一步确认。
商品化Matchmaker GAL4 酵母双杂交系统的组成
1. 载体质粒:pGADT7,pGBKT7,pGADT7-P53,pGBKT7-ADT,pGBKT7-Lam
2. 酵母菌株:AH109
阳性对照:pGADT7-T,pGBKT7-P53
阴性对照:pGADT7-T,pGBKT7-Lam
(LaminC蛋白少与其它蛋白相互作用) 假阳性检测质粒
实验组:pGADT7-X,pGBKT7-Y
对照组:
pGADT7-X,pGBKT7
pGADT7,pGBKT7-Y
pGADT7,pGBKT7
说明:载体本身带有-Trp-Leu标记,质粒转化成功即可在二缺培养基上生长。若无相互作用,则四缺培养基无法生长。
试剂准备
10×TE buffer:0.1 M Tris-HCl(pH7.5),10 mM EDTA,高压或抽滤灭菌。
10×LiAC(1 M):称取10.2 g LiAC溶于80 mL蒸馏水中,用醋酸调pH值至7.5,加水定容至100 mL,高压或抽滤灭菌。
50% PEG4000:称取50 g PEG4000,加蒸馏水定容至100 mL,高压灭菌保存。
Herring Testes Carrier DNA(鲑精DNA):10 mg/mL溶于ddH2O中,分装后于-20℃保存。
0.2%Ade(腺嘌呤):称取0.2 g Ade溶于100 mL蒸馏水中,高压或抽滤灭菌。
40%葡萄糖: 称取40 g葡萄糖,加蒸馏水定容至100 mL,高压灭菌保存。
培养基:
YPDA:称取20 g Tryptone,10 g Yeast extract,至800 mL蒸馏水中,加入15 mL 0.2% Ade,调pH值至6.5,加水定容至950 mL。灭菌后再加入50 mL 40%葡萄糖。固体培养基则加入20 g/L琼脂粉。
SD/-Trp-Leu(二缺):称取0.64 g DO/-Trp-Leu,6.7 g YNB(酵母氮源),至900 mL蒸馏水中,NaOH调节pH至5.8,加水定容至950 mL。灭菌后加入50 mL 40%葡萄糖。固体培养基则加入20 g/L琼脂粉。
SD/ -Trp-Leu-Ade -His(四缺):称取0.60 g DO/ -Trp-Leu-Ade -His,6.7 g YNB,至900 mL蒸馏水中,NaOH调节pH至5.8,加水定容至950 mL。灭菌后加入50 mL 40%葡萄糖。固体培养基则加入20 g/L琼脂粉。
实验流程
1. 挑活化好的酵母菌株AH109单克隆,接种于5 mL YPDA液体培养基中。
2. 30℃,250 rpm,培养16-18 h。
3. 按每个反应10 mL的菌量计算所需的培养基体积。将过夜培养物转接入适量的YPDA液体培养基,30℃,250 rpm,培养至OD600为0.4-0.6。在30℃时,酵母约为2.5 h一代,可据此计算接入的菌量。
4. 开始收集菌体时,准备变性鲑精DNA。沸水浴中煮10 min,随后立即插冰上备用。
5. 将培养好的细胞转入50 mL离心管中。室温,4000 rpm,5 min,收集细胞。
6. 弃上清,1/2体积无菌水重悬菌体。
7. 室温,4000 rpm,5 min,收集细胞。弃上清,用1/5体积1×TE/LiAC重悬。
8. 室温,4000 rpm,5 min,收集细胞。弃上清,用1/100体积1×TE/LiAC重悬。
9. 30℃,200 rpm,培养30 min(可缩短或取消)。
10. 准备转化的质粒:将1 μg质粒DNA(共转化时,两种质粒各为1 μg)及2 μL 10 mg/mL的变性鲑精DNA加入2 mL离心管中,充分混匀,总体积不应超过10 μL。
11. 加入100 μL酵母感受态细胞并轻轻混匀,30℃,200 rpm,培养30 min(可缩短或取消)。
12. 加入600 μL PEG/LiAC溶液(40% PEG,1×LiAC,1×TE)。轻轻吹打混匀。
30℃,200 rpm,培养30 min-90 min。
13. 加入70 μL DMSO,轻轻颠倒混匀。
14. 42℃水浴中热激10 min。冰上放置2 min。
15. 室温,4000 rpm,离心2 min。弃上清,加100 μL无菌水重悬细胞。
16. 将细胞悬液各取一半涂于SD/-Trp-Leu和SD/- Trp-Leu- Ade-His平板上。
17. 28℃培养一周后观察并拍照。
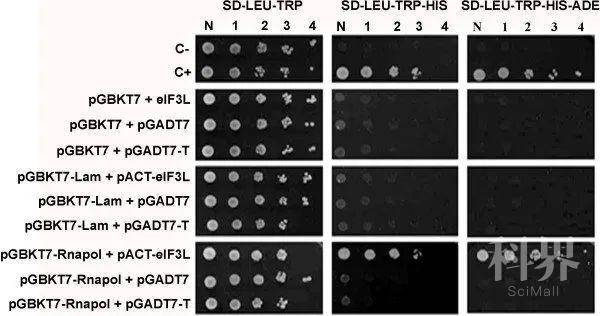
图2. 结果示例
来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247494589&idx=5&sn=416bc6927d67451f05b5bd7354652b35
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

DNA损伤修复蛋白动力学研究获进展

DNA到底能不能预测外貌?
合成生物学: 一个用来控制转基因生物的内置毁灭开关
《科学》:揭示蛋白BAF阻止细胞攻击自身DNA机制

李继刚团队建立用于研究光敏色素与信号分子光可逆互作的LexA酵母双杂交系统

新研究揭开人类头发曲直的秘密

自然中不存在的蛋白质也能人造了!撼动材料医药界
Nature:DNA错配如何影响蛋白质-DNA结合?

科学家探索物种间DNA组成多样性背后的奥秘
非对称聚合物材料可制造灵活多变的软机器人