科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-18
来源:BioArt
对于大部分人来说,毕业后的第一份工作和结婚可能是人生中非常重要的事件。但是对生命而言,最重要的事件就是受精后胚胎细胞增殖和功能分化 (囊胚阶段),这对成功孕育新生命,组织器官形成发育,甚至对出生后代的疾病发生(例如老年痴呆症)都具有深远的影响。但是,到目前为止,科学家还没有很好的方法来模拟囊胚的形成方式。
2019年10月17日,Salk研究所Juan Carlos Izpisua Belmonte研究团队、德克萨斯大学西南医学中心吴军团队、以及北京大学第三医院的合作团队在Cell杂志上以长文(Article)的形式发表 Generation of Blastocyst-like Structures from Mouse Embryonic and Adult Cell Cultures的研究。
在这项工作中,研究人员首次从单个培养的细胞中制造出小鼠囊胚样结构(Blastoid,类囊胚)。这些培养的“类囊胚”与自然囊胚结构非常类似,甚至可以植入子宫中。类囊胚可以帮助推进胚胎发育相关的研究,以及解释妊娠失败,不育症或一些早期发育对后代健康的影响等问题的机理。

自然囊胚植入子宫内后变成胎儿,这个过程很难研究。动物模型(例如小鼠)每次只能产生有限的囊胚,因此科学家很难采用高通量的手段用于测试营养不良或接触毒素或各种遗传或表观遗传突变对早期发育的影响。
Salk研究所、西南医学中心及北京大学第三医院的合作团队更加开创性地使用成年小鼠体细胞开发了类囊胚。体细胞先被重编程为诱导性多能干细胞(iPSC),然后将它们在特殊的培养基中进行培养,以扩充其发育潜力变成全能性干细胞(Extended pluripotent stem cells,EPS) 细胞。
事实上,早在2017年,北京大学邓宏魁教授课题组在Cell上发表重要研究成果【1】,就首次在国际上建立了具有全能性特征的多潜能干细胞系——EPS细胞,获得的细胞同时具有胚内和胚外组织发育潜能,并且该研究中还证明了人EPS细胞的异种嵌合能力,为未来利用异种嵌合技术制备人体组织和器官奠定了基础,为干细胞技术治疗重大疾病提供了新的可能(详见BioArt此前报道:【突破】邓宏魁团队Cell报道新型多能干细胞系),而今日在线发表的工作正是建立在2017年的工作基础之上,邓宏魁教授还作为署名作者之一。
为了诱导EPS细胞形成类囊胚,研究人员将细胞培养在微孔板中,每个孔培养大概五个细胞,以模拟4-8细胞期的受精胚胎。这些小细胞团很快彼此形成连接(compaction),并开始极化(Polarization)。进而内外细胞层开始分化,外层的细胞开始激活重要Hippo信号通路关键调控因子YAP,YAP进入细胞核后,激活滋养外胚层相关的转录因子表达。这些都是8-16细胞期受精胚胎经历的发育事件。类囊胚的形成模仿了自然的发育过程,这是已知的第一次在体外培养的细胞中,系统性模拟了受精胚胎早期发育的这些重要事件。
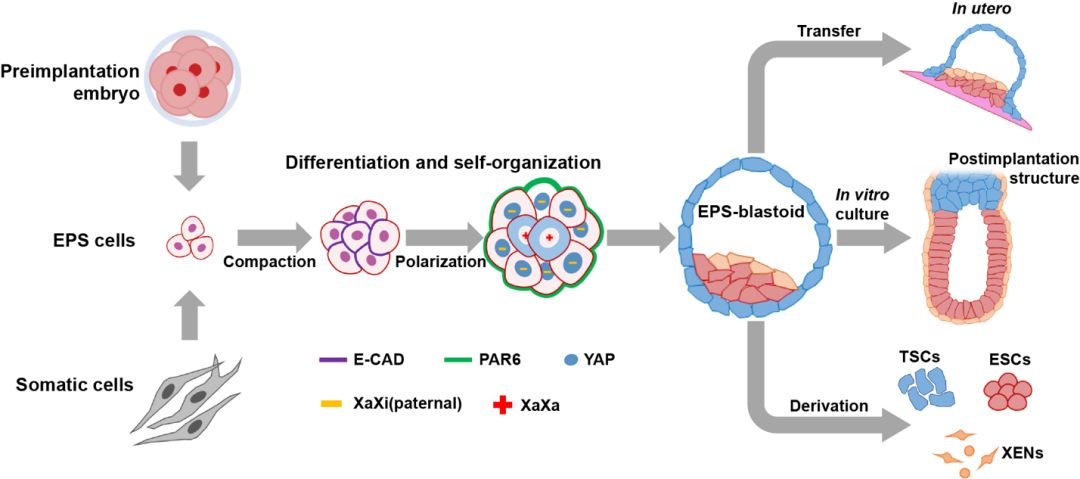
类囊胚包含有自然囊胚中的三种原始细胞类型。单细胞转录组测序分析显示,类囊胚与自然囊胚有相似的基因表达特征。进一步实验表明,类囊胚可以在体外发育成类似于早期植入后胚胎的结构。据悉,该团队接下来计划将基因编辑工具(例如CRISPR-Cas9)与类囊胚模型结合起来,以研究与妊娠失败相关的遗传改变如何影响三种不同细胞类型的组成和发育的临床与科学问题,同时类囊胚还可以用于测试新药物的有效性和化学药品的毒性。
目前类囊胚还不能在体内发育成胚胎。相反,移植到子宫后类囊胚会长成结构混乱的组织。但是研究团队中方负责人,北京大学第三医院于洋副研究员认为,经过体系的调整,类囊胚很可能发育到形成器官原基的阶段,这些器官原基可以用于生成类器官,成为细胞甚至器官移植的重要来源。
“我们这些研究将帮助研究人员更好地理解生命的开始,及在生命的早期单个细胞如何可以产生数百万个细胞,它们又如何在空间和时间上组装成完整的生物。更为重要的是,这项工作避免了自然胚胎的使用,并且容易实现高通量的扩增。” Salk研究所基因表达实验室的通讯作者Juan Carlos Izpisua Belmonte教授说。
诺贝尔奖得主Richard Feynman曾经说过:“What I cannot create, I do not understand”.“时至今日,从受精卵开始形成新的个体的过程仍然是一个正在探索的奥秘,而我们的类囊胚方法展示了我们已经开始揭示该过程的早期阶段。只要有足够的时间和资源,相信我们可以破解生命的密码,并在实验室中对其进行重现。” 德克萨斯大学西南医学中心的通讯作者吴军说。
据悉,该研究的第一作者为Salk研究所基因表达实验室博士后李荣辉、钟翠青和北京大学第三医院生殖医学中心/临床干细胞研究中心的于洋副研究员。参与研究人员包括索尔克研究所的刘海松、石磊、Yuta Takahashi、廖信凯和Concepcion Rodriguez Esteban。北京大学第三医院闵喆莹,西南医学中心的Masahiro Sakurai、于乐谦、魏育蕾;圣安东尼奥·德·穆尔西亚天主教大学的Estrella Nuñez Delicado。北京大学第三医院乔杰教授与北京大学邓宏魁教授亦对本研究给与重要指导。
原文链接:
https://doi.org/10.1016/j.cell.2019.09.029
参考文献
1、Yang, Y., Liu, B., Xu, J., Wang, J., Wu, J., Shi, C., ... & Deng, H. (2017). Derivation of pluripotent stem cells with in vivo embryonic and extraembryonic potency. Cell, 169(2), 243-257.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476714&idx=2&sn=f598f33a6d536bd170c73a4c4332832f&chksm=84e2069eb3958f88df2d549a83221fe26755d4b36fbb21db681888d6c9c13aa8d6736a18a800#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
人体长期以来被忽略的“器官”——间质被重新发现

北京大学第三医院徐明课题组发现心力衰竭疾病进展中关键代谢物分子

走近病理科(二十五)北京大学医学部病理学系暨北京大学第三医院病理科
中国工程院院士、北京大学第三医院院长乔杰:必须跟时间赛跑

研究人员成功用人类干细胞模拟人类囊胚 规避科研伦理问题

北京大学第三医院医学创新研究院荣获第二届全国创新争先奖

我们已进入一个移植器官过时的年代

中国科学家首次破译细胞“返老还童”二维码

Cell Stem Cell | 谱系示踪揭示骨骼肌内的储备肌干细胞
Cell Research:利用小鼠二细胞胚胎建立具有形成类囊胚能力的新型全能性干细胞