科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-25
来源:BioArt
责编 | 兮
耳毛细胞(hair cells)上的静纤毛(stereocilia)是听觉发生时把机械信号(声波)转化为电信号(离子通道打开使细胞去极化从而形成受体电位)的重要场所。相邻的静纤毛间有钙粘蛋白家族复合物形成的顶端连接(tip-link),使得其在耳毛细胞顶部形成规则的阶梯状的结构。研究表明,一类严重的遗传性耳聋疾病——尤塞氏综合征(Usher Syndrome)的致病基因编码的蛋白质均与顶端连接或顶端连接下的胞内区域有关,而相对应的转基因小鼠模型的静纤毛的排列紊乱。
早在上世纪八十年代,通过电子显微镜的观察,已经发现了在tip-link在静纤毛的两端插入点,分别存在着一个蛋白致密区,称之为upper tip link density(UTLD)和lower tip link density(LTLD)【1】。尽管形成这些蛋白致密区的主要蛋白质已知(UTLD即由上述尤塞氏综合征的其中三个致病基因所编码的蛋白质的组成),然而它们具体是通过什么样的机制形成致密区仍然是一个谜。
2019年10月22日,香港科技大学张明杰课题组在Cell Reports杂志上发表文章Myosin VII, USH1C, and ANKS4B or USH1G Together Form Condensed Molecular Assembly via Liquid-Liquid Phase Separation,揭示了UTLD形成的可能机理。

研究人员在前期的工作中已经阐明了静纤毛UTLD组成蛋白Myosin VIIa,USH1C和USH1G的两两互作机制,受课题组早前关于突触致密区是通过蛋白质相分离机制形成的研究(详见BioArt报道:Cell丨张明杰组破解突触的建立与可塑性调节的机制——温文玉解读;Mol Cell丨张明杰组报道相分离对于重新认识突触的形成与维持的重要意义)【2-4】的启发,猜想这三个蛋白质的多价态相互作用模式可能也可以使其通过相分离机制而自发形成聚集体(condensates)。然而尽管经过大量尝试,在体外仍然很难纯化得均一稳定的Myosin VIIa和USH1G全长重组蛋白,因而无法进行体外重组实验。
庆幸的是,同样的研究团队近年来已经发现,与静纤毛形貌极其相似的位于小肠表面的微绒毛,也存在着钙粘蛋白家族形成的tip-link,而其胞内蛋白与静纤毛中高度同源(Myosin VIIb,ANKS4B和USH1C),相互作用模式也高度相似【5,6】。于是研究人员决定另辟蹊径,首先体外重组包括Myosin VIIb的整个尾部以及USH1C和ANKS4B全长的复合物。实验结果表明,Myosin VIIb、USH1C和ANKS4B这三个蛋白在生理条件下(低蛋白浓度,正常盐浓度和pH值)能自发地通过相分离机制形成蛋白聚集体。并且通过测量聚集体和溶液中各蛋白的浓度发现,在聚集体中,相应蛋白浓缩了超过1500倍。
根据相分离理论,多价态相互作用可引发相分离现象。为了验证这一理论仍适用于本系统,研究人员通过加入竞争者、设计点突变等策略,证明了之前发现的Myosin VIIb、USH1C和ANKS4B这三个蛋白间的两两相互作用对相分离的发生至关重要。
接下来,为了证明静纤毛中Myosin VIIa/USH1C/USH1G采用与微绒毛中Myosin VIIb/USH1C/ANKS4B相同的机制形成蛋白聚集体,研究人员借助细胞生物学手段,分别将两个系统的这三个蛋白共同转染入HeLa细胞进行观察。结果证明,无论是静纤毛中的Myosin VIIa/USH1C/USH1G还是微绒毛中的Myosin VIIb/USH1C/ANKS4B,均能通过相分离形成蛋白聚集体。
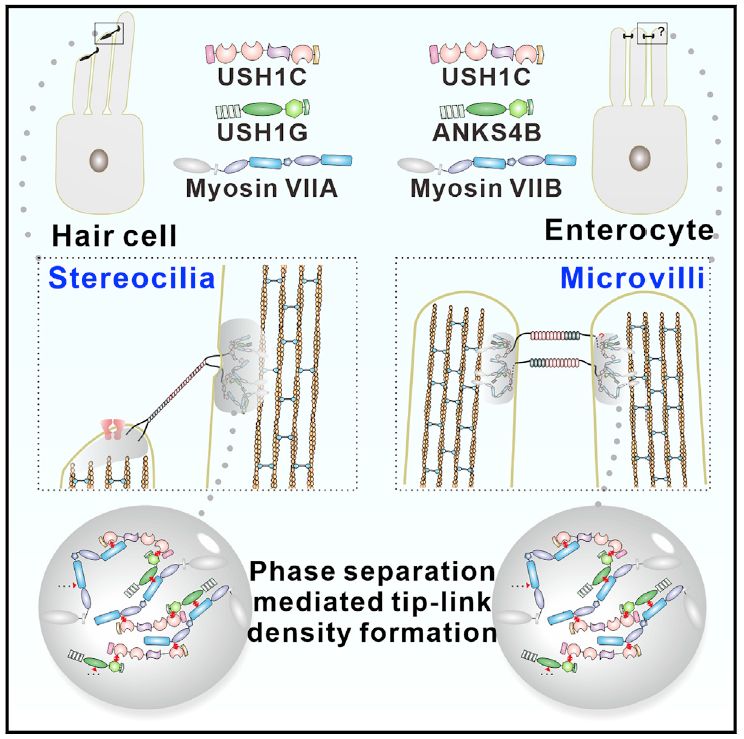
最后,由于在尤塞氏综合征病人中已在Myosin VIIa的编码基因上发现了大量的致病点突变,研究人员进一步发现,这些致病点突变都会影响相分离的发生,因此可能会导致UTLD的缺失,从而使得静纤毛排列紊乱。这解释了尤塞氏综合征患者的疾病发生机理,为未来可能的治疗提供前期的积累。
据悉,本文的第一作者为刚刚毕业的博士生何云运博士,香港科技大学张明杰教授为本文的最后通讯作者,共同通讯作者李健潮博士曾为张明杰教授团队博士后,2018年入职华南理工大学医学院任教授。
原文链接:
https://doi.org/10.1016/j.celrep.2019.09.027
制版人:珂
参考文献
1. D. N. Furness, C. M. Hackney, Cross-links between stereocilia in the guinea pig cochlea. Hear Res 18, 177-188 (1985).
2. M. Zeng et al., Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175 e1112 (2016).
3. M. Zeng et al., Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell 174, 1172-1187 e1116 (2018).
4. X. Wu et al., RIM and RIM-BP Form Presynaptic Active-Zone-like Condensates via Phase Separation. Mol Cell 73, 971-984 e975 (2019).
5. J. Li, Y. He, Q. Lu, M. Zhang, Mechanistic Basis of Organization of the Harmonin/USH1C-Mediated Brush Border Microvilli Tip-Link Complex. Dev Cell 36, 179-189 (2016).
6. J. C. Li et al., Structure of Myo7b/USH1C complex suggests a general PDZ domain binding mode by MyTH4-FERM myosins. P Natl Acad Sci USA 114, E3776-E3785 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476889&idx=6&sn=f9fa68415b03c61fc2d6f8b9c929aad2&chksm=84e2066db3958f7b0fff5dd68dc86108c057897161807f854595b02e7765937f72ff47ad9ff2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Cell:父系行为如何受到调控?
Cell Stem Cell | 夏云组利用类器官揭示肾脏发育中的谱系关系



Cell Stem Cell:中南大学林戈等揭示不同亲本对人类植入前发育的影响

Cell Stem Cell:皮肤是突变的战场?
Cell揭密神奇的肠道细菌
Cell Stem Cell | 辛利组揭示微环境调控前列腺干细胞增殖的机制

Cell Stem Cell:自然界的奇葩蛋白,驯服基因组的“跳跃”序列
研究透视:Cell综述-水凝胶
mTORC2控制线粒体膜通透性,调节自噬流量并影响寿命长短

Cell Stem Cell | 谱系示踪揭示骨骼肌内的储备肌干细胞