科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-25
来源:研之成理

▲第一作者:彭磊;通讯作者:闫海龙
通讯单位:重庆大学药学院
论文DOI:10.1002/anie.201908961
前言
今天很荣幸邀请到重庆大学闫海龙教授课题组来对他们近期发表的 Angew. Chem. Int. Ed. 进行分享。本文由论文第一作者彭磊博士撰写,内容充实,这其中不仅有其对论文的理解,还有许多做课题的心得,希望能够帮助大家更好地理解这篇论文。在此,特别感谢重庆大学闫海龙教授课题组的大力支持。
研究背景
吲哚是最重要的杂环系统之一,存在于许多复杂的天然产物和合成药物中。在研究吲哚的合成方法上已经有了大量的报道,其中邻炔基苯胺的环化已经成为合成吲哚及其衍生物的重要合成手段,该策略已广泛应用于合成含吲哚的天然产物/药物中。尽管研究人员在该领域已经取得了优异的成就,但大多数这些反应都需要过渡金属催化或苛刻的反应条件。因此,开发一种高效且无需过渡金属催化的邻炔基苯胺环化的方法仍然具有挑战性。
底物的设计合成
首先这个课题是在我们对联烯醌 (VQM) 这个中间体有了充分的认识后,对前期工作的一个延伸。我们的前期工作是通过分子内的 [4+2] 反应发展了一种高效手性构建 [5-6-5] 含氧三元并环结构的方法,这个方法实质是 2-(苯基乙炔基)萘酚在金鸡纳碱硫脲催化作用下发生质子重排产生了联烯醌中间体,然后联烯醌中间体与苯并呋喃发生了分子内的 [4+2] 反应从而构建了含氧三元并环结构。
在受到前面工作的启发下,我们设想把呋喃的双键换成具有亲核性的氨基,当我们把底物做出来在前面工作相同的反应条件下得到的环化产物产率很高但是没有手性控制。于是,我们对底物进行了改造也就是对氨基的取代基进行了改变。开始我们在氨基上引入了叔丁氧羰基和苯基,结果发现这两个官能团的引入对反应的产率没有太大的影响,但得到的产物均为消旋体。接着我们将叔丁基和对甲苯磺酰基引入到了氨基上,令人惊喜的是得到了较高的产率和对映选择性。于是我们对反应条件进行了筛选,最终得到了最佳的反应条件。
有了最优反应条件后,我们便开始了底物扩展部分的工作。底物扩展部分主要分为两个方面,一方面是在萘上引入不同取代基,另一方面就是在苯胺的苯环上引入不同的取代基。通过该方法我们总共获得了29个含萘基-C2-吲哚的轴手性化合物。
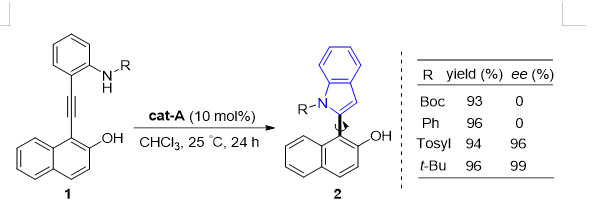
▲Fig. 1 Initial discovery.
热外消旋化实验
在完成了底物扩展部分的工作后,我们对制备的轴手性萘基-C2-吲哚化合物 2a 进行了热外消旋化实验。实验结果显示 2a 在 110 ℃ 的甲苯中半衰期约为 9902 小时,这表明了 2a 的高耐受性。化合物 2a 的热稳定性显示出了其作为不对称合成中手性配体或有机催化剂的前体的潜力。
克级反应制备及产物转化
为了证明该合成方法的实用性,在最优的反应条件下我们进行了数十克级别的制备轴手
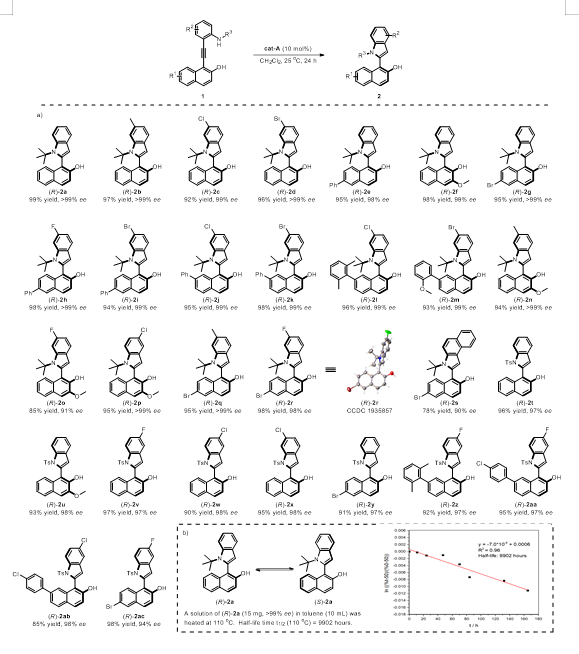
▲Fig. 2 a): Reaction conditions: 1 (0.05 mmol), A (10 mol%) in CH2Cl2 (1.0 mL) at 25 °C for 24 h. Yields are those of the isolated products. The enantiomeric excesses were determined by HPLC analysis. b): Racemization study.
性萘基-C2-吲哚化合物 2a。首先,从 1.0 g 1a 的原料开始,获得了具有高产率和高对映选择性的轴手性产物 2a(98 % yield, >99 % ee)。接着我们将 1a 的量增加到 50.0 g 同时将催化剂的当量由 10 mol % 降为 5 mol %。当反应完成后将溶剂悬干,用 DCM/hexane (1:10) 重结晶得到了高产率和高对映选择性的轴手性产物 2a(90 % yield, >99% ee)。接着向原反应体系中重新加入 50.0 g 的 1a 和溶剂继续反应。待原料消耗完后将溶剂悬干,用 DCM/hexane (1:10)重结晶依然得到了高产率和高对映选择性的轴手性化合物 2a(94% yield, >99% ee)。在该策略中回收的催化剂 A 易于重复使用而且没有显著的催化活性和对映选择性的损失,表明该方法可以应用于轴手性萘基-C2-吲哚的大量制备。
为了进一步的扩大环化反应的合成效用,我们尝试着将得到的轴手性化合物去进行一系列官能团的转化(3a-3i),并将其应用到了催化剂的合成上(3i)。在得到了 3i 之后,我们对其催化效能进行了检验。首先我们将3i作为催化剂将其应用到了 MBH 反应中得到了高产率
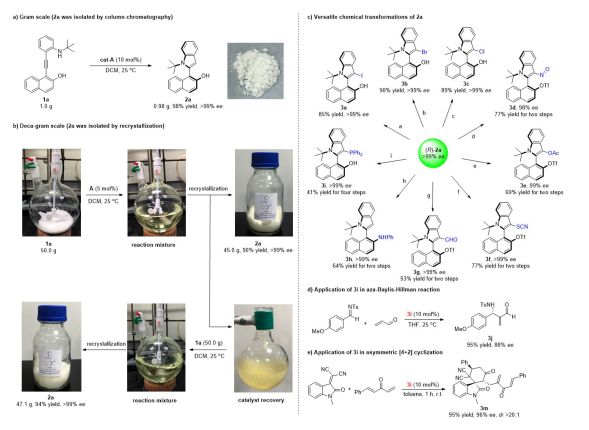
▲Fig. 3 a): Gram-scale preparation. b): Deca-gram scale preparation. c): Versatile chemical transformations of 2a. Reagents and conditions: (a) NIS, DCM, 0 °C; (b) NBS, DCM, 0 °C; (c) NCS, DCM, 0 °C; (d) Tf2O, Et3N, DCM, 0 °C; t-BuONO, CH3CN; (e) Tf2O, Et3N, DCM, 0 °C; PhI(OAc)2, AcOK, Pd(OAc)2, CH3CN; (f) Tf2O, Et3N, DCM, 0 °C; Oxone, NH4SCN, MeOH; (g) Tf2O, Et3N, DCM, 0 °C; DMF, POCl3. (h) Tf2O, Et3N, DCM, 0 °C; Pd(OAc)2, Cs2CO3, Xant-Phos, toluene, 105 °C. (i) NBS, DCM, 0 °C; NaH, MOMCl, THF, 0 °C; n-BuLi, PPh2Cl, THF, -78 °C; HCl, MeOH. d): Application of 3i in aza-Baylis-Hillman reaction. e): Application of 3i in asymmetric [4+2] cyclization.
和高对映选择性的加成产物 3j (95 % yield, 88 % ee), 接着我们利用 3i 作为催化剂参与到了 [4+2]的环化反应中并得到了相应的加成产物 3m (95 % yield, 96 % ee, >20:1 dr)。
结论
本课题报道了第一例有机小分子催化的通过邻炔基苯胺不对称环化来构建轴手性的芳基-C2-吲哚骨架。该策略可适用于数十克级别的轴手性的芳基-C2-吲哚类化合物的高效合成,得到的产物能进行多样的官能团转化,这些性质使得该合成策略的实用性大大增加。此外,我们合成的 3i 可作为手性催化剂参与到 MBH 反应和 [4+2] 环化反应并得到了较高的产率和对映选择性。
致谢
这个课题前后做了大半年的时间,接收的时间刚好是教师节这一天。刚从网站上刷到接收的消息的时候内心是很开心的,因为这个课题前后出现了很多波折,不过最终还是被自己给克服了,这种成功的喜悦是不言而喻的。在做这个课题的过程,遇到了很多的困难同时也收到了来自课题组两位老师和实验室伙伴们的帮助。尤其是在投文章的前两个月和补数据期间大家更是和我一起加班做实验,在此表示由衷的感谢。这篇文章是我的第二篇 angew,相比第一个课题来讲这个课题让我学到的东西更多,让我学会了在科研的道路上遇到困难解决困难,也让我的内心得到了历练。最后希望大家在科研的道路上不仅能收获文章,更能收获做课题带来的快乐。
文章链接:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201908961
来源:rationalscience 研之成理
原文链接:http://mp.weixin.qq.com/s?__biz=MzIwMzE5MzQ1NQ==&mid=2649334770&idx=4&sn=06ab65ff7ae58b17569c5c5a8c984162&chksm=8ece2ef2b9b9a7e4b7d759249599a1f220ca60ad369c86c1a2db5a0ecb75e795a4518e676be0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
JACS:旧配体新手性!谭斌团队利用BINOL配体高效构筑轴手性联芳基化合物
无氰源合成手性腈类化合物

Nature:惰性二氟亚甲基单元构建手性单氟化合物
Science:平面手性大环化合物的生物催化合成
兰州化物所在不对称碳氢键硼化研究方面取得进展


新成果助力手性胺类和醚类化合物高效合成
胺脱氢酶合成手性胺醇化合物研究取得进展

【每日科技速递】北京科技奖拟增“中关村奖”
理事推荐|Science封面:“你戳我,我就扭”的超材料诞生!



钯(II)/手性螺环磷酸(SPA)催化的轴手性联芳基化合物的立体选择性构筑