科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:X一MOL资讯
注:文末有研究团队简介及本文科研思路分析
免疫分析是目前临床检测生物标志物最重要的工具之一,其中高特异性的抗体和高灵敏度的检测方法发挥了至关重要的作用。然而,抗体制备周期长、价格昂贵,存在不稳定和重现性差等问题。同时,免疫分析检测需要相应的标记或放大试剂,如放射性同位素、酶、荧光和化学发光探针等。但是放射性同位素对健康有害,酶不稳定且容易失活,而荧光和化学发光探针易受样品环境的影响。面对以上问题,人们已经制备出一种新型仿生识别材料用于取代抗体——分子印迹聚合物(MIPs),其是在模板存在下通过共聚反应合成的具有抗体结合性能的化学合成受体。与抗体相比,MIPs具有制备简单、成本低廉、结构稳定、耐受各种恶劣环境等优点。而表面增强拉曼散射(SERS)由于具有灵敏度高、读取速度快、对样品和实验环境的敏感性低、可用于现场检测等优点,已经成为一种新型高灵敏检测方法。通过MIPs与SERS结合,近年来发展出了一种免酶、免抗体的检测方法,硼亲和三明治夹心法(BASA)和更新版本的等离激元免疫夹心法(PISA)。特别是,PISA通过萃取基底和SERS纳米标签之间的额外放大机制,能够提供超高灵敏度,已经证明在疾病诊断和单细胞分析等实际应用中具有巨大潜力。然而,在所有基于MIP的三明治夹心法中,MIPs仅作为目标物的捕获探针,而必须使用其他方法而不是MIPs进行标记。这是因为使用的MIPs通常采用整个目标物作为模板进行印迹,所以MIPs一旦与目标物结合,只剩下目标物表面有限的部分可用于标记。因此,极大限制了基于MIP的三明治夹心法的应用和发展。
近日,南京大学化学化工学院生命分析国家重点实验室刘震教授团队报道了一种称为“基于双重分子印迹聚合物的等离激元免疫夹心法(duMIP-PISA)”,用于复杂生物样品中蛋白质生物标志物的高特异性和超灵敏度检测。这种新的分析方法得益于作者团队最新开发的硼亲和锚定表位可控定向表面印迹法。不同于整个目标物作为模板的分子印迹方法,该方法能够方便有效的印迹C端表位肽段。通过结合特有的末端肽片段,为蛋白质和肽段的特异性识别提供了新的途径。在本研究中,作者进一步将该方法扩展到了N端表位肽段的印迹。因此,制备的蛋白质C端和N端表位印迹的MIPs能够同时结合蛋白质生物标志物的两个不同位点,丰富了MIPs的识别类型,产生了新的PISA方法,涵盖了范围更广的蛋白质生物标志物。同时,由于采用了基于有机硅氧烷的表面印迹,这非常有利于维持等离激元效应。duMIP-PISA的原理和步骤如图1所示,制备的C端表位印迹的单层AuNPs自组装玻璃板作为等离激元基底,用于从复杂生物样品中特异性萃取蛋白质生物标志物,而N端表位印迹的Ag/PATP@SiO2 NPs作为拉曼纳米标签,用于特异性标记捕获的蛋白质生物标志物。
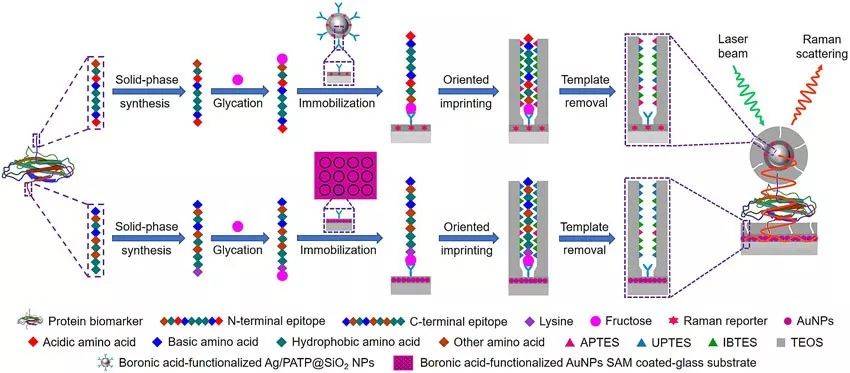
图1. duMIP-PISA测定蛋白质生物标志物的原理示意图。
duMIP-PISA具有双重MIPs的识别作用,与基于单一MIP的PISA相比,能够提供更高的特异性,已经成功测定了健康人和小细胞肺癌(SCLC)病人血清中神经元特异性烯醇化酶(NSE)。与商品化的ELISA试剂盒相比,duMIP-PISA具有操作简单、耗时短、所需样品体积少和线性范围宽等优点,而且能够很容易地扩展并检测其他蛋白质生物标志物。因此,duMIP-PISA在疾病诊断方面将发挥重要作用。
表1. duMIP-PISA与商品化ELISA试剂盒的比较。
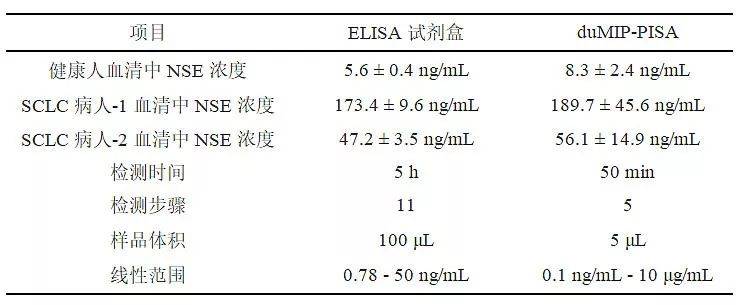
(健康人血清中NSE浓度的参考值: 0 - 16.3 ng/mL)
这一成果近期发表在Analytical Chemistry 上,文章的第一作者是南京大学博士研究生邢荣荣(现就职于山西医科大学),化学化工学院的刘震教授为论文的通讯作者。
刘震教授简介
南京大学特聘教授,博士生导师,国家杰出青年基金获得者。1998年于中国科学院大连化学物理研究所获博士学位。2000-2002年,日本兵库大学日本学术振兴会(JSPS)特别研究员;2002-2005年,加拿大滑铁卢大学博士后。2005年获聘南京大学教授,2006年起任博士生导师,2008年入选教育部“新世纪优秀人才”, 2011年-2014年任加拿大滑铁卢大学工程学院兼职教授,2014年获国家杰出青年科学基金,2016年入选江苏省“333高层次人才”(第二层次)。兼任国际分子印迹学会理事会理事、中国质谱学会常务理事、中国化学会质谱专业委员会委员、中国生物化学与分子生物学会蛋白质组学专业委员会委员、《Analytica Methods》副主编、《Analytica Chemica Acta》、《Electrophoresis》、《Separation Science Plus》、《科学通报》、《分析化学》、《质谱学报》和《色谱》等杂志编委。主要从事分子识别、亲和分离、疾病诊断、单细胞分析和癌症纳米治疗等研究,主持国家重大科研仪器项目和基金委重点项目等国家级科研项目10余项,已在Chemical Society Review,Accounts of Chemical Research,Angewandte Chemie International Edition,Nature Protocols,Chemical Science等期刊上发表论文140余篇,目前h因子43(谷歌学术),主编及合著著作2部,出版专章7章,获授权专利12项。2011年和2017年先后获中国分析测试协会科学技术奖一等奖共2次,2016年获Phenomenex & Analytical Scientist联合颁发的科学人文奖银奖。
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:如上所述,现有的三明治夹心法中MIPs仅作为目标物的捕获探针,而必须使用其他方法进行标记,这极大限制了基于MIP的三明治夹心法的应用和发展,因此我们进一步提出了萃取基底和拉曼纳米标签均为MIPs的duMIP-PISA,其中基于MIPs的双重识别保证了检测的高度特异性,同时SERS检测提供了超高的灵敏度,相比传统的免疫分析具有更大的优势。
Q:研究过程中遇到哪些挑战?
A:本项研究中最大的挑战在于如何制备MIPs,通过控制印迹过程,优化印迹条件,得到了高特异性、强亲和力的C端表位印迹的单层AuNPs自组装玻璃板,作为等离激元基底用于从复杂生物样品中特异性萃取蛋白质生物标志物,以及N端表位印迹的Ag/PATP@SiO2 NPs,作为拉曼纳米标签用于特异性标记捕获的蛋白质生物标志物。在这个过程中,我们课题组在印迹材料制备方面积累了多年的丰富经验,起到了至关重要的作用。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:duMIP-PISA是一种高特异性和超灵敏度的检测方法,具有成本低、稳定性好、操作简便、检测速度快、样品消耗低和检测范围宽等优点,因此在疾病诊断、生化研究和信号通路等领域将发挥重要作用。通过进一步发展,相信能够为医院或医学诊断机构提供一种更为强大的检测工具。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657622026&idx=6&sn=96bf0a5cc0c90400b2827a686292436d&chksm=80f831dab78fb8ccc783c9dceb7ad6aac7752c7ba6f10c7160cc94a92172516a558bf89f04df&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

阿尔茨海默氏症检测研究获进展

【干货】拉曼光谱常见问题集锦!

收藏 | 拉曼光谱实用问答集锦!

中国科学院海洋研究所深海高温热液喷口流体原位拉曼定量探测获新进展
西安光机所芯片集成微腔光学频率梳研究获进展----中国科学院

—文读懂Mxene的拉曼光谱分析

他让拉曼光谱变得更强

古脊椎所等利用拉曼光谱揭示哈密翼龙蛋壳化石成分
我国实现颗粒物毒性活体生物标志物无创在线监测

拉曼光谱——实验、第一性原理计算简介