科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:X一MOL资讯
原标题:华侨大学陈爱政教授团队:基于超小铂纳米粒的肿瘤深度穿透体系及其对多药耐药肿瘤的协同治疗
肿瘤化疗导致多药耐药以及药物难以渗透至肿瘤深处是目前肿瘤临床治疗中普遍存在且难以克服的问题之一。近日,华侨大学生物材料与组织工程研究所陈爱政教授团队构建了一种pH响应型超小铂纳米粒包覆锌掺杂的介孔二氧化硅载药纳米复合体,能够实现在肿瘤部位深度穿透并协同治疗多药耐药肿瘤。
使用不同小分子化疗仍是目前临床用于治疗癌症或辅助手术和放射治疗的最常用手段之一。然而,这种传统的治疗方法高概率地产生肿瘤细胞的多药耐药性,同时药物外排泵蛋白(如p-糖蛋白、MDR相关蛋白1)过度表达,从而导致药物无法发挥应有的作用。此外,肿瘤耐药的相关生理屏障(如肿瘤组织渗透差)也是化疗诱导多药耐药的主要原因之一。尽管利用一些纳米载体能有效提高药物的生物利用度,但仍存在负载率不高和传递效率低、不易穿透至肿瘤组织深处等问题。
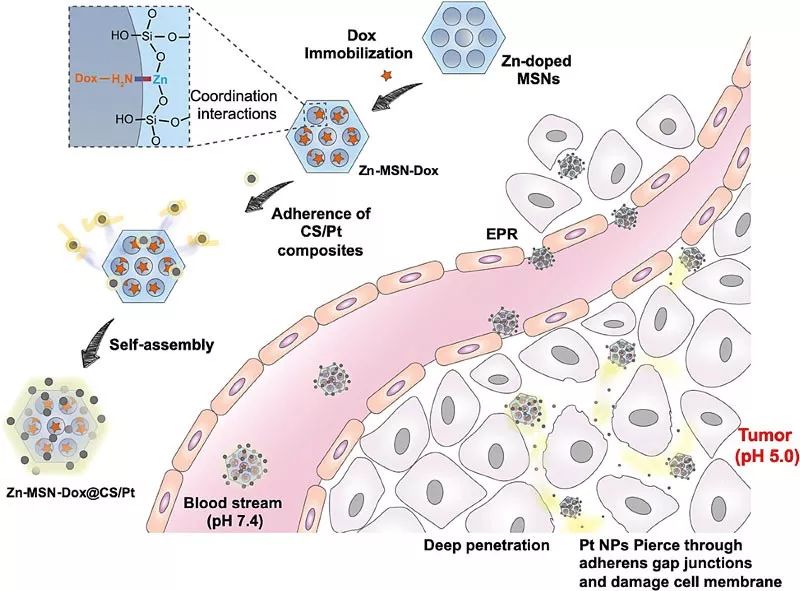
图1. 纳米复合体合成与肿瘤深度渗透示意图
华侨大学陈爱政教授团队构建了一种超小铂纳米粒包覆锌掺杂的介孔二氧化硅载药纳米复合体(Zn-MSN-Dox@CS/Pt)。一方面,超小铂纳米粒在肿瘤酸性微环境下解离,易于在肿瘤组织中渗透并增大细胞间隙,有利于纳米颗粒向肿瘤深处穿透;另一方面,纳米复合体进入细胞后释放药物阿霉素,提高细胞内自由基水平,催化超小铂纳米粒溢出具有生物毒性的Pt(II),从而协同杀死多药耐药肿瘤细胞。
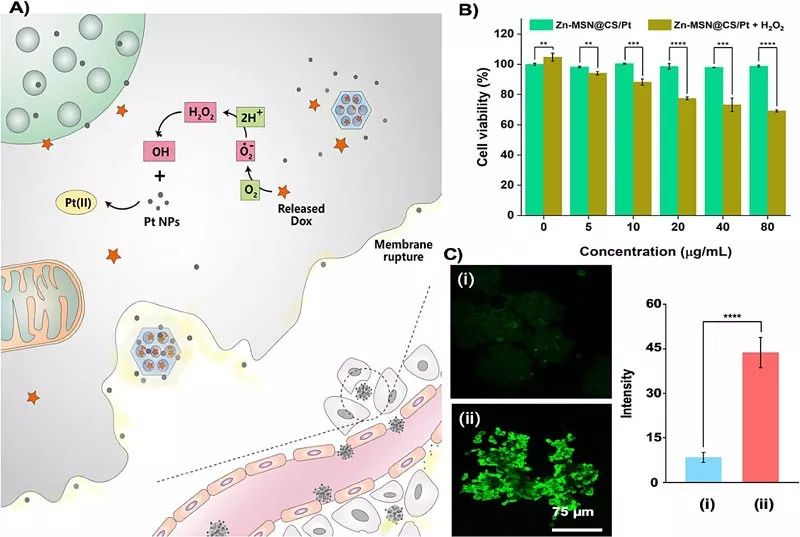
图2. (A)细胞内作用示意图;(B)有无自由基协同条件下铂纳米复合体对MCF-7/ADR细胞的细胞毒性;(C)细胞内ROS水平荧光照片和荧光强度:(i)阴性对照,(ii)纳米复合体培养。
实验表明,与直接给药相比,通过超小的铂颗粒扰动肿瘤细胞间细胞膜相互连接,加大细胞间隙后,载药纳米复合体能够更好地渗透至3D肿瘤团块内部,从而药物可被携带至更深层的癌细胞中,一定程度上克服了相关生物屏障。此外,阿霉素发挥药效的同时也通过提高的胞内自由基水平协同催化,加速了铂纳米粒溢出铂离子,对多药耐药肿瘤细胞杀伤效果显著增强。
这一成果近期发表在Chemical Engineering Journal上,文章的共同第一作者是华侨大学Ranjith Kumar Kankala博士和2018级博士研究生刘晨光,通讯作者为华侨大学Ranjith Kumar Kankala博士和陈爱政教授,华侨大学王士斌教授及福建医科大学杨达云副教授为论文的共同作者
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657621726&idx=6&sn=a501c8a683b8f919ffa58a32aa28ec83&chksm=80f83f0eb78fb6189455260f5dd3289fc51e2188872c16a62e09126c5011cab8670373f660a6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn