科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:X一MOL资讯
吡啶杂环作为一类重要结构单元,广泛存在于生物活性分子、天然产物和功能材料中。因此,发展新的合成方法,实现吡啶衍生物的高效构建是合成化学的重要研究领域之一。基于吡啶环的亲核取代反应(SNAr)或过渡金属催化吡啶的C-H键官能团化反应是合成取代吡啶衍生物的常用方法,然而,此类方法往往需要金属有机试剂或过渡金属的参与,反应条件相对苛刻,底物范围受限。通过碳自由基对吡啶杂环的自由基加成反应(Minisci反应)是合成烷基化吡啶的一种有效的方式,但是该类反应的存在区域选择性的问题。因此,发展简单、高效的取代吡啶衍生物的合成方法具有重要意义。
近日,南京大学化学化工学院黎书华课题组利用量子化学计算结合实验研究的策略发展了一种基于路易斯酸选择性调控自由基脱羧吡啶化反应的新方法,实现了一系列含吡啶取代基的大位阻季碳中心的构建(图一),相关成果发表在美国化学会旗下期刊ACS Catalysis 上。

图1. 路易斯酸催化的羧酸NHPI酯选择性脱羧吡啶化反应
2016年,黎书华教授课题组与朱成建课教授题组合作,首次提出利用“双吡啶分子协同活化硼-硼键”的反应模式原位产生“吡啶-硼基自由基”(Angew. Chem. Int. Ed., 2016, 55, 5985)。随后,该策略被广泛应用于羰基衍生物与氰基吡啶、1,1-二取代烯烃等的还原偶联反应(J. Am. Chem. Soc., 2017, 139, 3904; Chem. Sci., 2018 , 9, 3664),羧酸NHPI酯与烯烃的还原偶联反应(Chem. Commun., 2018, 54, 11534),烷基胺的C-N键硼化反应(Angew. Chem. Int. Ed., 2018, 57, 1),以及烯烃的多氟烷基化-吡啶化反应等(Chem. Sci., 2019, 10, 2767)。基于前期工作基础,黎书华等人提出吡啶-硼自由基诱导羧酸NHPI酯产生的烷基自由基可与吡啶-硼自由基发生选择性自由基交叉偶联反应,进而有望发展出一种能够避免Minisci反应的选择性问题的吡啶衍生物合成新方法(图2a)。
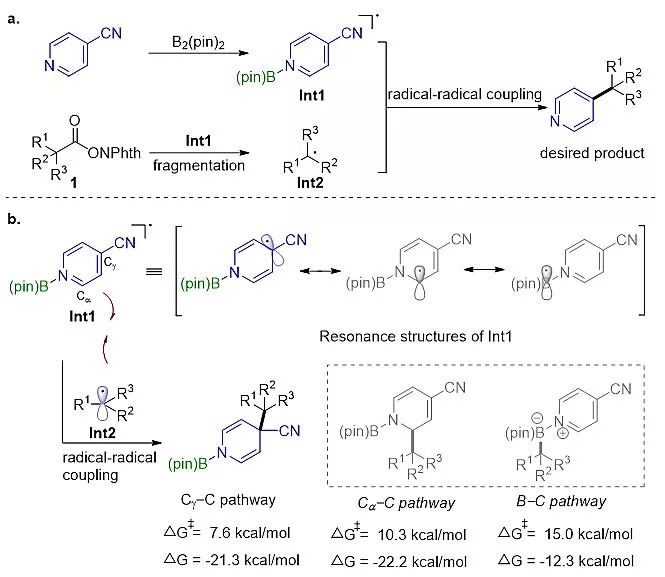
图2. 计算设计的羧酸NHPI酯的脱羧吡啶化反应
然而,他们的计算结果表明,脱羧产生的烷基自由基与吡啶-硼自由基的偶联反应存在多条能量相近的竞争通道(图2b, 包括Cγ-C, Cα-C, B-C等反应路径);后续的实验研究也证明了Cγ-C, Cα-C偶联反应路径的同时存在。不过,这种区域选择性问题可以通过向反应体系中加入Lewis酸得以解决。最终,经过反应条件优化,以ZnCl2为催化剂,实现了自由基脱羧吡啶化反应的选择性调控。值得注意的是,该反应可以应用于吡啶取代的季碳中心的构建中,同时兼具良好的官能团耐受性和底物适用性(图3)。最后,作者通过DFT计算和一系列的控制实验证明ZnCl2在降低反应过渡态势垒、提高Cγ-C路径的选择性和交叉偶联反应中间体的芳构化等步骤起到至关重要的作用(图4)。
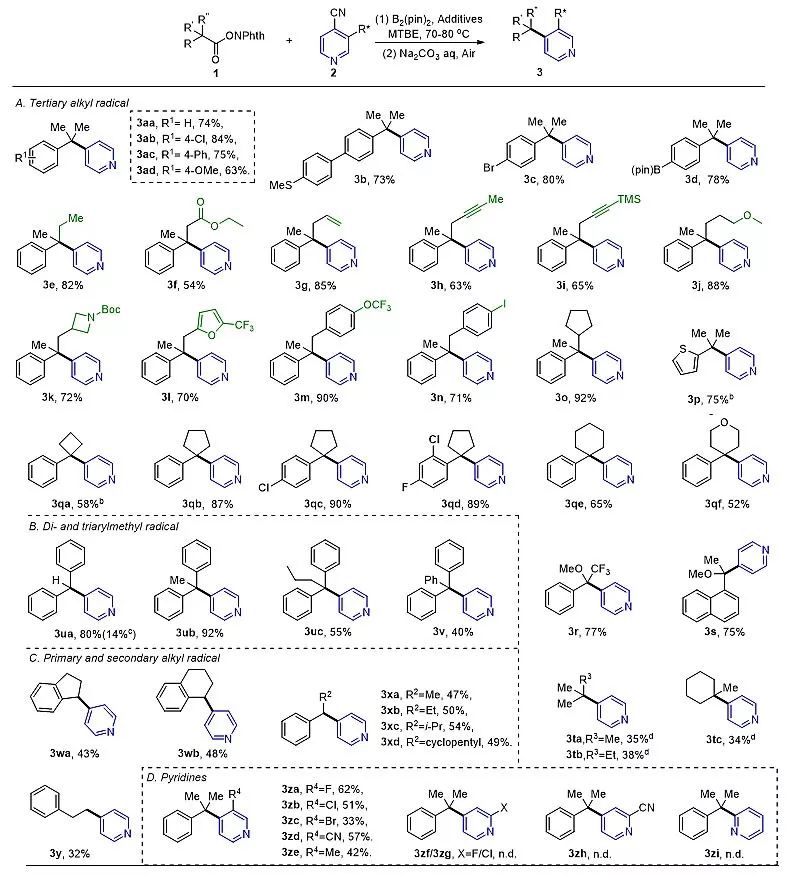
图3. 底物的适用范围
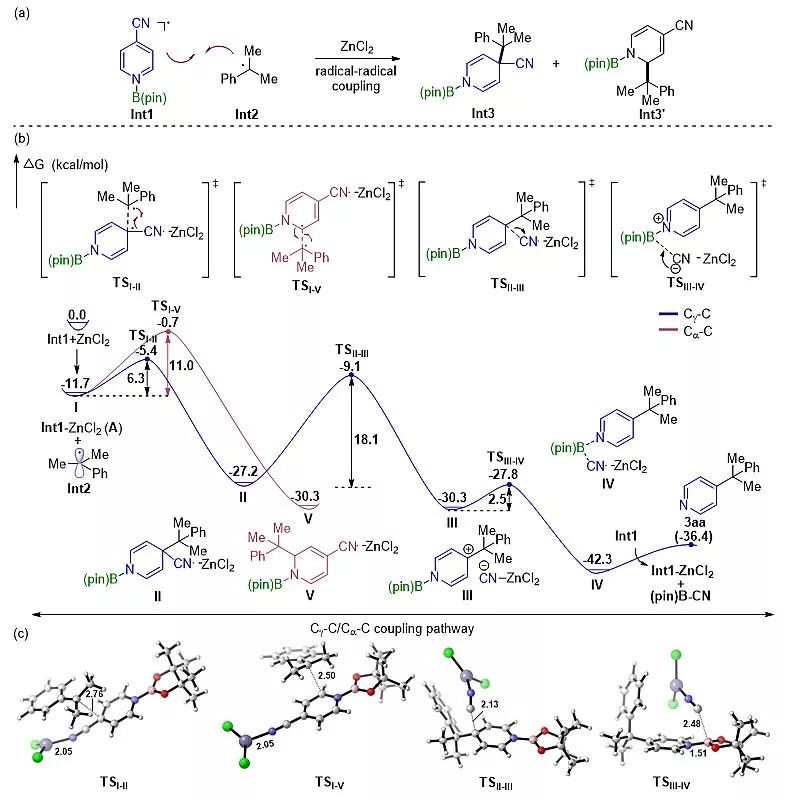
图4. DFT计算揭示ZnCl2在反应中的作用
总结
黎书华课题组基于量子化学计算和实验研究相结合的方式,提出了Lewis酸催化羧酸NHPI酯的选择性脱羧吡啶化反应。该策略能够在相对简单、温和的条件下实现了一系列4-取代吡啶衍生物的高效合成,具有广泛的底物适用范围和良好的官能团耐受性。深入的机理研究揭示了Lewis酸在该自由基偶联反应中的调控作用,这或许能为Lewis酸在自由基化学中的应用提供新的启示。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657621726&idx=4&sn=9dfdd8c7689a66057f75229bd7fac407&chksm=80f83f0eb78fb6180268624cba589b49930d1083d6053d13657407fe18a9c9a265c1e5a90350&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
JACS:首例自由基关环/开环串联聚合反应
聚合反应方法新突破:用细菌实现可控自由基聚合
基于可见光促进的脱羧反应形成硅基自由基的新方法
串联自由基环化/分子间偶联反应合成苯并呋喃衍生物
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结

Angew: NHC有机小分子催化实现烯烃的自由基酰基氟烷基化反应

复旦大学张琪课题组:基于硫鎓的自由基取代反应
JACS:镍催化的不对称自由基接力还原偶联反应
Angew:NHC催化实现烯烃的自由基酰基氟烷基化反应
可见光引发活化酯的脱羧自由基-极化交叉氟化反应