科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-16
来源:X一MOL资讯
苏州大学李瑞宾研究团队首次通过调控金团簇表面蛋白冠制备了高量子产率及生物相容性的红外II荧光探针,并将其用于胃肠道肿瘤的诊断。相关成果发表于Angewandte Chemie International Edition 杂志上。
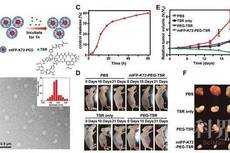
近红外II区 (NIR-II) 荧光由于其具有深度组织穿透的优势,是未来生物医学成像的一种重要的技术手段。尽管目前已经有小分子(IR-26)、AgS、稀土纳米颗粒被用于红外II成像的尝试,但是其荧光量子产率非常有限(<1%),且容易在胃肠道的酸性多酶环境发生生物转化及荧光淬灭。开发用于胃肠道成像的NIR-II探针极具挑战性。鉴于金元素优良的生物惰性及相容性,苏州大学李瑞宾研究团队尝试通过配体-金属电荷转移(LMCT)理论,对金团簇表面修饰以实现其发射光红移至红外II区。尽管软配体(含有巯基)对于金团簇的形成至关重要,理论计算表明芳香供电子配体的引入对于其HOMO-LUMO能带隙的压缩至关重要。如图1,考虑到天然氨基酸丰富的种类及生物相容性,研究团队通过“鸡尾酒”式氨基酸组合的方式,实现了金团簇发射光的红移,并依次构建了RNase-A包封的金团簇 (RNaseA@AuNCs)。该团簇的最大荧光发射峰在1050 nm,量子产率高达1.9%,可以实现胃肠道蠕动的实时、高分辨成像。RNaseA@AuNCs胃肠道成像灵敏度是传统AgS、稀土纳米颗粒的50倍。利用该成像技术对小鼠肠道肿瘤的分辨率可达2.5 mm,能够成功从正常小鼠中确诊肠癌小鼠(p = 2.6×10-5,图2)。
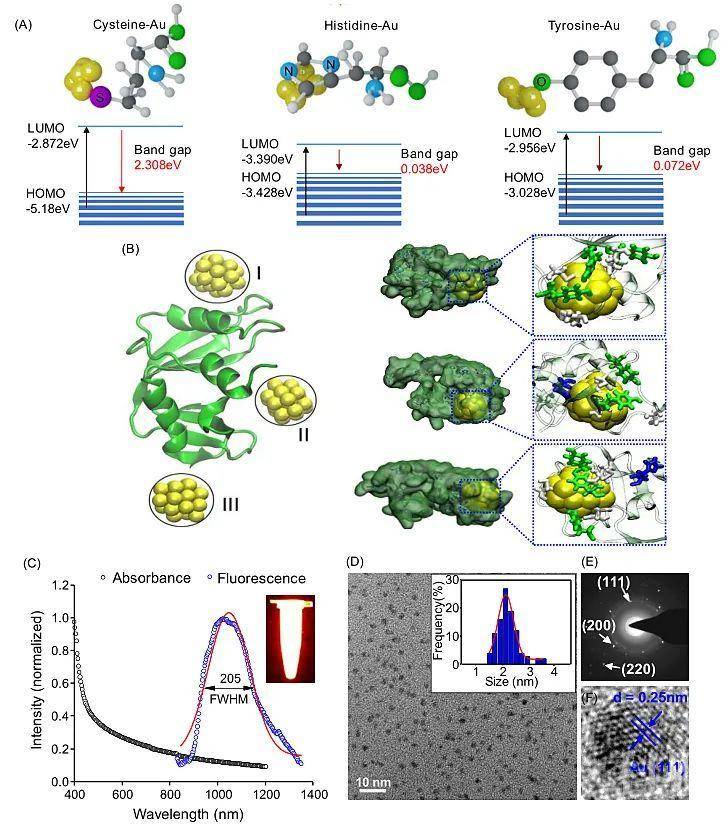
图1. RNaseA@AuNCs纳米团簇荧光红移机制与表征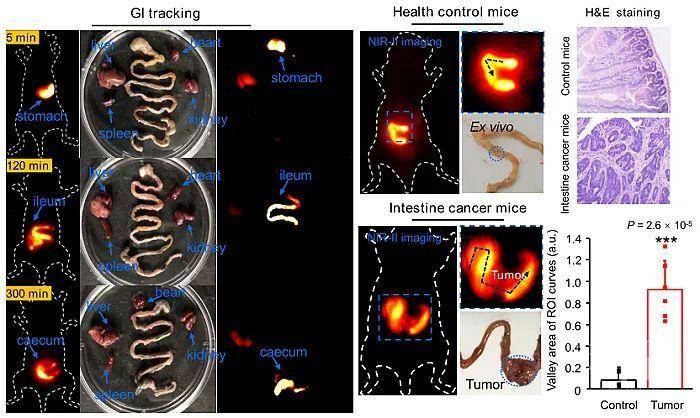
图2. RNaseA@AuNCs纳米团簇胃肠道红外II成像
该研究拓宽了配体-金属电荷转移理论(LMCT)的适用领域,为未来通过引入不同化学结构配体合成其他金属基红外II纳米团簇提供了可能性。苏州大学放射医学与防护学院王威力博士为该论文第一作者、李瑞宾教授为通讯作者,哈佛大学孔毅飞博士为共同第一作者。该工作得到国家自然科学基金(基金号:21976126, 31671032),科技部国际合作重点项目(基金号:2018YFE0120400)等基金的资助。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657664076&idx=6&sn=845c2b5489ffef251f42b924d2db1547&chksm=80f8959cb78f1c8a2fc3bf2dbe57dce531b1a61945bf32d7f56da8fc52007e56729ee620c5fc&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

近红外II区聚集诱导发光的荧光探针实现术中输尿管成像
深圳先进院研制出近红外二区荧光寿命成像系统
中国—奥地利纳米科技及新材料研讨和对接洽谈会在深圳举行



深圳先进院等研发新型近红外二区荧光介观成像系统
镧系掺杂纳米探针用于易分离的活体双通道近红外二窗成像

中美研究人员开发出三维纳米“剪纸”结构
Adv. Mater.:经过工程改造的近红外荧光蛋白组件用于生物成像和治疗

纳米级厚度氧化铝涂层或可完美防腐
苏州纳米所受邀发表近红外II区活体荧光成像展望----中国科学院

用于癌症生物标志物GUS检测成像的高灵敏点亮型近红外荧光探针