科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-17
来源:BioArt
脂肪组织具有显著的可塑性,不仅用于被动的能量储存,还可以响应并影响体内许多生理过程,是包含多种细胞类型的复杂环境。最典型的例子之一是克罗恩氏病(Crohn’s disease, CD)中出现在肠道外的“爬行脂肪(creeping fat, CrF)”,即发炎和纤维化肠周围肠系膜脂肪组织(mesenteric adipose tissue,MAT)的扩张。CrF在视觉上也非常有“冲击力”(前方高能,CD患者切除肠断CrF示意图),呈手指突起状延伸,紧紧包裹住累及肠段(见图1A上),而临近未累及肠段的MAT则柔韧附着在肠道一侧边界(见图1A下)。CrF本身与受累肠道组织倾向于严重纤维化,脂肪侵入肠肌层(见图1B),这是在CD患者中观察到的一致的组织学特征。值得注意的是,CrF在其他形式的炎症性肠病(inflammatory bowel diseases, IBDs)如溃疡性结肠炎(ulcerative colitis, UC)中并未发觉,且这一表型自1932年首次发表以来一直是“未解之谜”【1】。
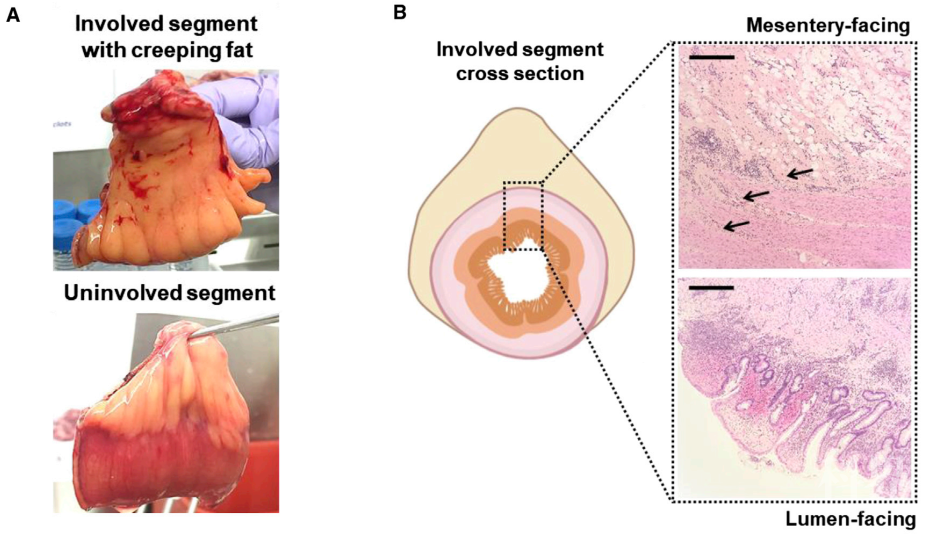
图1. CD患者中受累和未累及肠段特征
近日,来自美国西奈医学中心的Suzanne Devkota课题组在Cell杂志上发表了题为 Translocation of Viable Gut Microbiota to Mesenteric Adipose Drives Formation of Creeping Fat in Humans 的文章,该研究提供证据表明,在炎症性肠病患者中,被称为“爬行脂肪”的现象其实是一种保护性反应,肠系膜脂肪组织迁移到肠屏障功能障碍的部位,以阻止潜在的有害病菌透过肠腔在宿主体内发生系统性传播的事件发生。

首先,研究人员从11位由于CD并发症而接受手术切除的患者中共获得五种样品,分别是受累肠段(CD iMUC),配对的未累及肠段(CD uMUC),黏附的CrF,未受累的肠系膜脂肪组织(CD MAT)和血液;同时,也收集了来自13名UC患者的类似区域(分别标注为UC iMUC,UC uMUC,UC iMAT,UC uMAT,以及血液),作为没有CrF时肠道炎症的对照组;此外,研究人员从4名非IBD结肠手术恢复后接受回肠造口术的受试者中获取回肠粘膜(H Muc)和附着的肠系膜脂肪组织(H MAT)及血液作为健康对照组(见图2)。研究人员通过对比CD和UC中的MAT和MUC的菌群成分,没有发现明显区别,提示MAT并不代表新的微生物生态位,而是菌群从邻近肠道的易位结果。
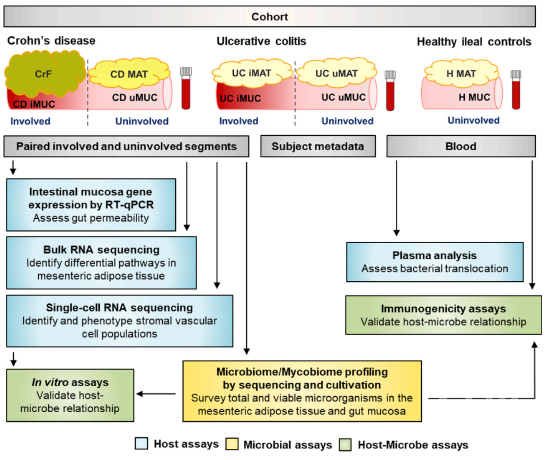
图2. 实验设计模式图
虽然测序分析可以提供MAT的确存在微生物DNA的证据,但并不能确认这些微生物是抵达MAT即死亡的“被动旁观者”,还是积极生存在MAT的“主动参与者”。随后,研究人员即在UC和CD患者及4例健康对照的MAT中分离出活菌株。鉴于无法从H MAT或H MUC以及UC MAT中分离出存活的C. innocuum,而在CD MAT中则可以分离,研究人员进一步将来自MUC和MAT的30种C. innocuum分离株进行全基因组测序(WGS),结果揭示出1627个包含C. innocuum基因组保守核心的操作基因单元(operational gene units, OGUs),其中包括防止氧化损伤的基因,调节粘着和免疫逃逸的基因,以及细胞运动性的基因,这些保守基因归类的通路提示了向更富含脂质和富氧环境(例如脂肪组织)中易位的竞争优势。
接下来,研究人员想要知道可能促进细菌易位和CrF脂肪扩张的宿主环境,推测是否可归因于健康和IBD肠道通透性的差异。首先,通过检测从CD iMUC和uMUC,UC iMUC和uMUC以及H MUC收集肠道紧密连接标记物基因表达,CD和UC样本与H相比,除了MUC1(粘蛋白1),所有标记物的表达通常较低;与CD uMUC相比,CD iMUC中所测屏障基因除了MUC1和ZO-1(连蛋白1)外,表达水平均较低;值得注意的是,作为肠道通透性的替代标志物的血浆脂多糖结合蛋白(LBP)和可溶性CD14,与血液中循环细菌产物的含量成比例,且与UC相比,CD患者中LBP和CD14的水平明显降低,而与H MUC并无显著差异。这可能反映了CD中CrF的存在可以抑制细菌在炎症病变部位的全身扩散。
截止目前,尚无法预测哪些新诊断的CD患者会发生纤维化并发症,且仅在晚期才可进行手术切除。因此,无法前瞻性地预测这些患者中的细菌移位和CrF发展。此外,也不存在能够可靠地概括发现于人类的CrF动物模型。尽管如此,研究人员还是决定利用定菌小鼠(gnotobiotic mice)来确认是否可以前瞻性地观察C. innocuum向MAT的转运,如果可行,是否会导致MAT发生任何变化。首先,研究人员向无菌小鼠中接种ASD(altered Schaedler flora)——含8种细菌的特定菌群,随后经口服接种源自人CrF的C. innocuum,并于第14日处死。其中,一组接种C. innocuum的定菌小鼠予以葡聚糖硫酸钠(dextran sulfate sodium, DSS),以确认易位是否需要肠道屏障功能受损。结果显示,可以在接种的小鼠中观察到大量的肠系膜脂肪沉积,且在DSS处理组和未处理组的MAT中均分离出C. innocuum,表明炎症不是其易位的先决条件。此外,脂肪形成和纤维化相关基因表达提示,仅接种C. innocuum的小鼠表现出与脂肪形成有关的基因上调,而在C. innocuum + DSS组和PBS对照组中未观察到此现象。然而,胶原蛋白IV和VI,作为与脂肪纤维化有关的细胞外基质(extracellular matrix , ECM)成分在C. innocuum + DSS中高表达,提示C. innocuum在促进脂肪和ECM形成中的作用。
接下来,为了验证MAT扩张会减弱细菌产物的全身传播这一假设,研究人员检测了各个处理组的LBP水平。结果发现C. innocuum组的LBP水平与对照组相近,甚至更低,这与人类的研究结果相吻合。另一方面,C. innocuum + DSS组中尽管存在C. innocuum易位和MAT扩张,其LBP水平仍显著增加,这可能是由于DSS会在整个肠道引起损伤,因此在脂肪扩张区域外可能会发生微生物产物的泄漏或扩散。因此,这些数据证明,源自人CrF的C. innocuum进入含限定菌群的小鼠体内时,可以转移至MAT并促进以脂肪形成和纤维化为特征的脂肪扩张。
随后,研究人员通过单细胞RNA测序(scRNA-seq)鉴定出CrF和H MAT间1118个显著差异表达的基因,不出所料,在CrF中脂肪形成相关基因表达上调,而通路分析却显示富集得分最高的基因并非脂肪形成,而是与细胞对细菌产物的反应,吞噬作用,B和T细胞的分化和活化以及ECM的产生和组织等过程相关。此外,对细胞类型的分析将CrF表征为由促纤维化祖细胞以及由细菌易位引起大量涌入的适应性和先天性免疫细胞为主导的组织。为了测试C. innocuum是否能特异性指导这些反应,研究人员将来自CrF或CD MAT衍生的C. innocuum的新鲜裂解液与来自健康志愿者的PBMC巨噬细胞共培养,当单独暴露于C. innocuum时,它们表现出明显的拉长形态(巨噬细胞M2亚型特征)。研究人员因此推断C. innocuum可能会促进M2表型以重塑脂肪环境。
为了验证这一假设,研究人员从CD MAT分离了原代成纤维细胞和脂肪干细胞,这些干细胞从局部微环境中获得信号以增殖。将这些细胞直接暴露于C. innocuum裂解液或暴露于与C. innocuum共培养的巨噬细胞的条件培养基中。随后检测胶原蛋白I(COL1A1)和VI(COL6A3)以及透明质酸合酶1(HAS1)的基因表达,它们是CrF祖细胞群体中表达最高的基因,直接参与组织纤维化和重塑。结果显示,仅C. innocuum裂解物不足以调节这些基因中的任何一个。然而,巨噬细胞条件培养基却显著增加了COL1A1的表达,并具有增加HAS1表达的趋势。这些数据提示,C. innocuum需要一种免疫细胞介质来激发其促纤维化作用。
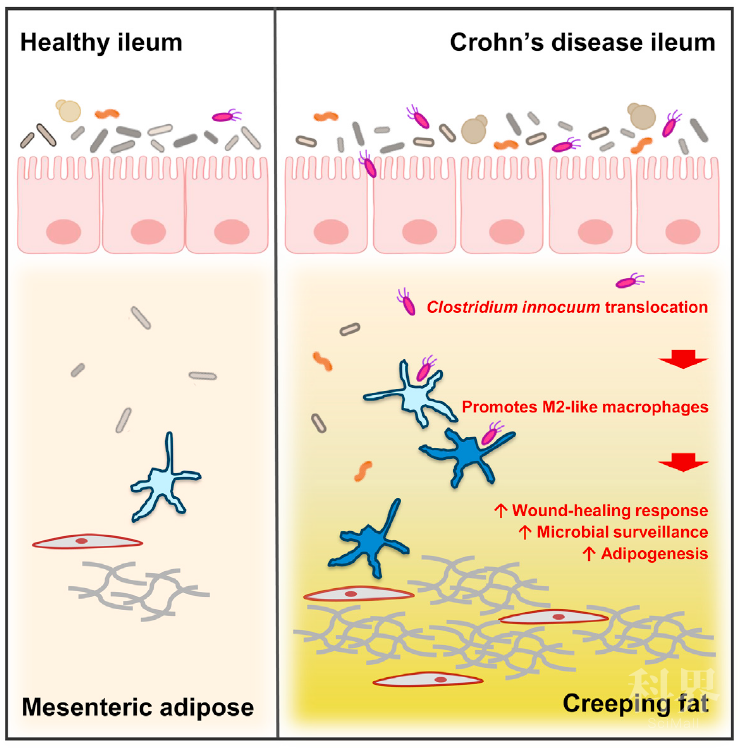
图3. CD中“爬行脂肪”形成机制示意图
总的来说,这项研究为脂肪组织在人体中的作用以及肠道微生物组如何影响其行为提供了新的见解。脂肪组织除了发挥能量存储的被动作用外,还可保护人体免受有害病原体在炎症或损伤部位的扩散。因此,假设这是克罗恩疾病患者中“爬行脂肪”发育的主要驱动力。这项研究中提供的数据有助于阐明人类CD中CrF是有害还是有益,亦或两者均有。对肠道损伤和细菌传播而言,CrF是对人体的保护性反应,并限制了全身性抗原暴露的附带损害;然而,这种伤口愈合反应继而导致肠系膜脂肪组织及其包裹的回肠段发生明显纤维化,虽然试图使炎症保持局部性,但 CrF侵入肠壁这些后果对患者也存在严重的负面影响。因此,在高风险患者中靶向C. innocuum的策略可能为预防或减轻纤维化级联反应提供一条途径。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652503867&idx=5&sn=5d89d1fb15271365fdef6eae804ef596&chksm=84e26c8fb395e5996629ad040d5aece876c51d78299ca083a4d77f618b48dab019ca590267ea#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

没做一个实验,背靠背发了两篇32分的nature子刊

夏季肠道疾病多发,你知道怎么应对吗?

Gut:抑郁症与肠道疾病之间的关系
胃肠道疾病
胃肠道疾病的超声检查
吃辣条或致肝衰、肠穿孔、克罗恩病?真相在这里

存在于肠道中神经胶质细胞将为治疗肠道疾病开辟新途径!

Microbiome:粪便微生物群移植可维持克罗恩病的缓解

西兰花护小鼠远离肠道疾病

口腔与细菌性肠疾的关系被揭示