科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-19
来源:BioArt
原癌基因MYC和抑癌基因TP53在维持正常细胞内环境稳态中起到不和或缺的作用。一方面, c-Myc通过诱导抑癌蛋白ARF的表达进而促进p53蛋白的稳定;另一方面,p53 通过转录抑制和miRNA介导等方式来反向调控c-Myc表达,形成了一个负反馈的调节机制。然而,肿瘤细胞中c-Myc的广泛性高表达和野生型p53的低表达提示这种负反馈的调控机制并不适用于肿瘤细胞,可能存在全新的调控机制。
近日,澳大利亚纽卡斯尔大学金雷研究员和张旭东教授合作在Nature Communications上发表了题为c-Myc inactivation of p53 through the pan-cancer lncRNA MILIP drives cancer pathogenesis的研究论文,通过分析TCGA数据库和ENCODE ChIP-seq数据,筛选出受c-Myc转录调控的泛癌高表达的长非编码RNA MILIP (c-Myc-Inducible Long noncoding RNA Inactivating P53)。在肿瘤细胞中MILIP破坏了SUMO E3连接酶TRIML2对抑癌蛋白p53的修饰和稳定作用,进而促进肿瘤的发生和发展。TCGA数据显示MILIP在肺癌、乳腺癌、结肠癌等18种癌症组织中高表达,可作为潜在的多种癌症诊断和治疗靶点。

研究人员发现:(1) 分析TCGA大数据筛选出包含MILIP在内的泛癌高表达的lncRNA;(2) MILIP高表达预示患者预后差,生存期较短;(3) MILIP的表达受到癌基因c-Myc的转录调控;(4) 敲低MILIP表达抑制了肺癌等多种癌细胞的生长和克隆形成能力,以及荷瘤小鼠的肿瘤生长;(5) MILIP 与SUMO E3连接酶TRIML2竞争结合p53蛋白,抑制了TRIML2介导的p53蛋白SUMO化,进而促进p53蛋白的泛素化降解。
该研究证明受c-Myc调控的泛癌高表达lncRNA MILIP结合并促进p53蛋白降解,进而诱导多种癌细胞的增殖以及肿瘤形成。由于肿瘤组织中MILIP的高水平表达与肺癌、乳腺癌及肝癌等肿瘤患者的预后不良和生存期短相关,因此MILIP的高表达是多种癌症发生的重要因素,并提供了潜在的治疗靶点。
近年来,随着靶向RNA的小核酸药物接连获得FDA的批准(Onpattro, 2018; Givlaari, 2019),具有靶向精准、开发周期短、药物成本相对较低等优势的“RNA疗法”迎来了技术成熟和产业蓬勃发展的春天。据悉,目前基于脂质纳米颗粒的靶向MILIP的RNAi药物正处于设计和初期筛选过程中。
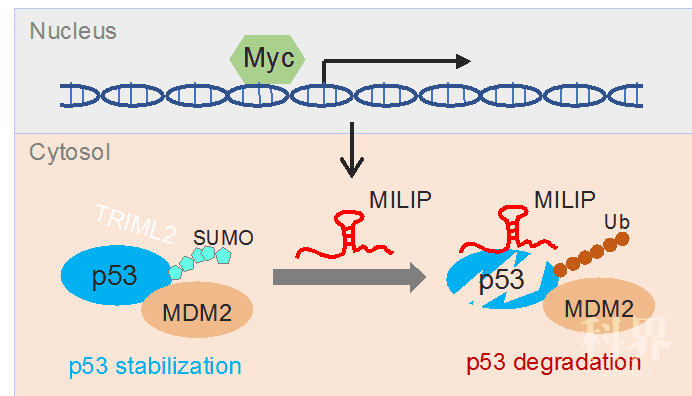
图1. c-Myc在肿瘤细胞中转录激活lncRNA MILIP表达,从而促进p53蛋白的降解
本文第一作者为澳大利亚纽卡斯尔大学的博士研究生冯羽晨。共同通讯作者为澳大利亚纽卡斯尔大学的金雷研究员和张旭东教授。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652504008&idx=6&sn=3df823e35e62b2ed5708f0ecd5892452&chksm=84e26c7cb395e56a52bc306bd480ffcf8ec4e18a23ccba15633cffc3ecd0782c438e6885311e#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science | 系统性揭示蛋白降解N端规则

Cell Reports:解码蛋白降解网络的系统蛋白周转图T-MAP
胸腹水纤维蛋白降解产物

靶向蛋白降解药物:细胞内做“猎头”,“借刀”灭掉致病蛋白
Science:泛素蛋白酶体途径介导microRNA降解

线粒体蛋白易位相关的降解
中国抗癌协会肿瘤介入学专业委员会换届会议召开




系统性揭示蛋白降解N端规则

蛋白质靶向降解PROTAC疗法的研究进展
蛋白质组学数据再分析揭示泛素降解系统在肿瘤发生中关键作用