科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-20
来源:中国医学科学院医学信息研究所
据统计,胃癌居全球恶性肿瘤发病率的第五位,死亡率居第三位,在亚洲胃癌死亡率仅次于肺癌。我国为胃癌高发国家,世界卫生组织统计显示,2018年全球胃癌的发病例数已超103万,我国占44%;总死亡人数逾78万,约一半为中国人。近年来胃癌的发病率逐年升高,社会负担和卫生经济支出负担也随之加重。手术结合放化疗是目前治疗胃癌的主要方法,但因胃癌早期症状隐匿,确诊时多处于中晚期,5年生存率仍不足20%。对化疗药物的普遍耐药也是导致疗效欠佳的主要原因之一。精准医疗是肿瘤诊断和治疗的一种新模式,已被广泛应用于医学的各个领域。目前基于基因的靶向治疗应用逐渐增多,致癌、抑癌基因在胃癌的靶向治疗中发挥着重要作用。现就当前胃癌致癌和抑癌基因的国内外研究现状进行总结,便于进一步探索胃癌的有效靶向治疗方法。
胃癌中关键致癌基因及其靶向治疗
1.1人表皮生长因子受体(HER)-2
HER-2定位于17q21,突变率为6.1%~23.0%。HER-2的表达升高可激活下游信号通路磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)和促分裂原活化的蛋白激酶(MAPK)途径,抑制肿瘤细胞凋亡、促进肿瘤血管再生、增强肿瘤细胞的侵袭力。临床研究显示,HER-2在发生远处转移、Lauren分型为肠型以及中高分化的胃腺癌患者中阳性率更高,与患者的年龄、肿瘤大小及位置无关。HER-2是受体酪氨酸激酶家族的重要成员之一,而酪氨酸激酶抑制剂在胃癌个体化治疗中有重要作用,可能是胃癌靶向治疗中潜力较大的靶向基因之一。
曲妥珠单抗是目前针对HER-2阳性胃癌患者的靶向药物,旨在干扰HER-2调控的信号通路,介导免疫反应,抑制血管生成和肿瘤细胞增殖力。应用曲妥珠单抗后HER-2表达明显降低,但HER-2阳性细胞不能完全消失,因此不能彻底根除肿瘤。为提高治疗效果,有学者采用曲妥珠单抗与化疗方案联合的治疗方式,结果显示,曲妥珠单抗与伊立替康+顺铂方案联合可降低糖类抗原125、癌胚抗原和特异性组织多肽抗原的水平;曲妥珠单抗联合多西他赛+替吉奥胶囊方案可降低血清糖类抗原724、糖类抗原199、癌胚抗原的水平;曲妥珠单抗联合奥沙利铂+亚叶酸钙+5-氟尿嘧啶方案可明显提高行为状态评分,并增强近期化疗的疗效。上述三种方案均可提高胃癌患者的生存质量,疗效更佳。
随着曲妥珠单抗的广泛应用,耐药问题也随之产生。Riccio等研究发现,T细胞招募双特异性抗体衍生物可以识别并结合两种及以上不同的抗原,对肿瘤细胞的毒性大幅增加;对曲妥珠单抗的耐药细胞也有效,可解决曲妥珠单抗的耐药性问题;还可降低心脏毒性等不良反应。Kubota等利用金纳米粒子(AuNPs)构建靶向HER-2的AuNPs(T-AuNPs),并在耐药细胞株MKN7上证明T-AuNPs抗瘤能力明显强于曲妥珠单抗。Shi等指出,曲妥珠单抗发生耐药的机制是神经调节蛋白1激活HER4-Yes相关蛋白1轴,促进Yes相关蛋白1表达,最终诱导上皮-间充质转化(EMT)发生。因此,干扰HER4-YAP1轴将有效降低耐药的发生。上述研究思路为胃癌治疗提供了新方法,为解决曲妥珠单抗耐药性问题提供了新策略。
1.2磷脂酰肌醇-3-激酶催化亚单位α(PIK3CA)
PIK3CA定位于3q26.3,突变率为10%,突变后激活PI3K/Akt通路,抑制细胞凋亡,增强癌细胞的侵袭能力和远处转移能力。与其他类型的胃癌相比,PIK3CA在EB病毒相关胃癌中突变明显升高,并与T分期和肿瘤浸润程度呈正相关。PIK3CA的突变常发生在第9和20位外显子,5年生存率分别为0和80%。
mTOR抑制剂(西罗莫司)可阻断由PIK3CA基因调控的与细胞周期进展和血管生成相关蛋白的翻译及表达有关的过程;应用西罗莫司后,患者的无进展生存期为1.9个月,总生存期为3.6个月。为延长生存时间,目前已有团队尝试采用其他种治疗方法。周新科等应用壳聚糖包被PIK3CA小干扰RNA制备纳米粒子,用该粒子处理胃癌细胞后,PIK3CA的表达降低,胃癌细胞侵袭性减弱。同时,You等在SGC-7901细胞中明确了miR-152-5p的作用靶点为PIK3CA-mut-3'非翻译区,研究显示miR-152-5p下调PIK3CA的表达、抑制SGC-7901细胞的增殖、迁移、侵袭、EMT及血管生成,并促进细胞凋亡,进而抑制肿瘤的生长和转移。该结果为PIK3CA突变型胃癌的靶向治疗提供了数据基础。
1.3鼠类肉瘤病毒癌基因(KRAS)
KRAS定位于12p12.1,是表皮生长因子受体(EGFR)信号通路的下游因子。KRAS突变后可致RAS蛋白非控制性激活。RAS蛋白位于细胞膜内,调控着细胞的生长、增殖、运动、迁移及血管生成,KRAS突变将显著增加胃癌的侵袭性。KRAS的表达在Lauren分型为肠型及女性胃癌患者中更高,其常见突变位点为G12V、G13D、G12S、G12D和G12A,与其他位点相比,发生在G12V的突变患者生存期较短,预后较差。
联合应用含Src同源结构域2的蛋白酪氨酸磷酸酶2和促分裂原活化的蛋白激酶激酶(MEK)抑制剂对野生型KRAS胃食管肿瘤效果显著。但Choi等认为,长期应用MEK抑制剂易出现耐药,并增加肿瘤的侵袭力,以c-MET和PI3K/mTOR为靶点的药物可以解决这一问题。近年来发现一种优于西妥昔单抗或帕尼单抗的新型抗EGFR抗体———GC1118,该新型抗体具有独特的结合表位,对胃癌的生长抑制较西妥昔单抗更强。研究显示,无论单独使用GC1118还是联合细胞毒性化疗药物,对胃癌的抗瘤作用均强于西妥昔单抗。
1.4 Erb-b2受体酪氨酸激酶(ERBB)3
ERBB3又名HER-3,定位于12q13,与ERBB2同属于EGFR家族,ERBB3通过激活一系列复杂的信号通路如PI3K/Akt和RAS/RAF/MAPK等发挥作用,ERBB3基因作为肿瘤发生的启动子,与胃癌的侵袭性和预后显著相关。有研究显示,ERBB3基因在Lauren分型为肠型的胃癌中呈高表达,说明其可促进肠型胃癌的发生。当ERBB3与ERBB1共过表达时,与肿瘤大小、宏观特征、肿瘤分化、肿瘤分期、复发显著相关,并可预测患者的生存情况。
吉非替尼是EGFR-酪氨酸激酶抑制剂的代表性药物。针对EGFR突变型胃癌,单独应用吉非替尼治疗,仅10%~15%的患者能从中获益。在细胞水平上,当吉非替尼与ERBB3小干扰RNA共用时能更有效地抑制PI3K/Akt和ERK信号通路,增强吉非替尼的抗瘤活性和敏感性。表明联合应用多个EGFR受体治疗可明显提高EGFR突变型胃癌的治疗效果。
1.5脂肪非典型钙黏蛋白1(FAT1)
FAT1定位于4q35.2,是一种钙离子依赖性黏附因子,属于Ⅰ型跨膜蛋白FAT家族,参与调节细胞的生长、迁移和黏附过程,在肿瘤的发生发展中发挥重要作用。FAT1基因在不同肿瘤中的作用不同,在食管癌中FAT1基因作为抑癌基因,而在胃癌中则起致癌作用。研究显示,FAT1基因主要参与胃癌细胞的侵袭和迁移,且表达量越高,预后越差。
目前在多种胃癌细胞系中检测到维替泊芬抑制胃癌细胞的生长,但作用机制尚不清楚。研究发现,应用维替泊芬后,迁移相关基因和具有致癌潜能的基因表达下调。因此推测维替泊芬是通过靶向FAT1抑制肿瘤转移的药物。
胃癌中重要的抑癌基因
2.1肿瘤蛋白p53(TP53)
TP53定位于17p13,是公认的重要的抑癌基因,被誉为“基因组卫士”。TP53是人类肿瘤中突变最频繁的基因,近50%的肿瘤发生TP53突变。TP53基因具有调控细胞周期、细胞凋亡和DNA修复等功能。TP53的突变位点集中在R175、G245、R248、R273和R282,其中R248位点突变的胃癌患者预后最差。
TP53可用于胃癌的超早期筛查,并可通过监测细胞游离DNA突变监测胃癌术后的复发情况,也可预测紫杉醇联合卡培他滨治疗晚期胃癌的疗效。Imanishi等通过研究TP53野生型胃癌发现,TP53可上调致癌基因鼠双微粒体(MDM)2和MDM4的表达,而自身功能被抑制;当同时敲减MDM2和MDM4时,可阻滞细胞周期G1期向S期进展,并提高5-氟尿嘧啶的抗肿瘤作用。因此,联合应用MDM2或MDM4抑制剂和细胞毒性药物将是治疗TP53野生型胃癌的一个有效策略。bamHI-A region rightward transcript(BART)-3p是EB病毒miRNA组的重要成员之一。研究发现,BART-3p可诱导TP53基因高表达,其通过直接作用于TP53的3'非翻译区,下调细胞周期蛋白依赖性激酶抑制因子1A、Bcl-2相关X蛋白质、凋亡因子FAS的表达,增强细胞增殖能力,抑制细胞凋亡。同时,BART-3p在诱导TP53高表达时能对化疗药物和电离辐射产生抗性。此研究首次证明了EB病毒miRNA与TP53的关系,可能有助于在未来开发治疗胃癌的新途径。
2.2 AT丰富结合域1A(ARID1A)
ARID1A定位于1p36.11,突变率为12%,参与DNA合成和基因转录的相关过程,其功能失调可导致染色质重构异常,进而引发肿瘤疾病。ARID1A的表达与肿瘤大小、淋巴结转移、预后呈显著负相关。在EB病毒相关胃癌中,ARID1A突变率较高,可通过激活Akt信号通路促进程序性细胞死亡配体1高表达。
研究表明,ARID1A突变型肿瘤细胞对PI3K和聚腺苷二磷酸核糖聚合酶抑制剂敏感,单独应用PI3K或PARP抑制剂时效果并不显著,两者联合应用时可通过诱导DNA损伤有效抑制ARID1A突变型胃癌细胞的增殖、克隆形成、侵袭和迁移,是该种类型胃癌的首选治疗方案。
2.3 腺瘤结肠息肉基因(APC)
APC定位于5q22.2,是Wnt通路的关键基因之一,突变常发生于第14和15位外显子,发生在70%~90%的家族性腺瘤性息肉病中。研究发现,APC基因与胃癌的分化和分期呈负相关,与淋巴结转移无关。APC基因突变后可改变蛋白表达、影响细胞周期调控增加胃癌的发病率。Magalhes等在弥漫型和肠型胃癌中发现,hsa-miR-135b-5p可负向调控APC基因,促进胃癌细胞的增殖和迁移。Yang等阐述了一种新型长链非编码RNA———LINC01133,通过启动miR-106a-3p调控APC或Wnt/β联蛋白通路,进一步抑制肿瘤的进展与转移。
2.4转化生长因子-βⅡ型受体(TGFBR2)
TGFBR2定位于3p24.1,参与许多细胞的生理调控过程,如细胞分化、细胞生长、细胞凋亡、细胞迁移,与胃癌进展呈负相关。研究发现,miR-204通过靶向TGFBR2介导上皮细胞发生EMT,提高胃癌细胞对5-氟尿嘧啶的敏感性,并改善肿瘤耐药。此外,miR-155和onco-miR-130可通过负调控TGFBR2,促进胃癌细胞的生长和侵袭,为胃癌的治疗和耐药研究奠定了一定的基础。
2.5 钙黏蛋白1(CDH1)
CDH1定位于4q28.1,主要编码上皮钙黏素,突变率较低,但后果严重,不仅可降低上皮钙黏素的活性,还可促进HER2的过表达。CDH1检测可用于遗传性弥漫型胃癌的筛查。CDH1突变具有遗传性,以常染色体显性方式遗传。携带突变CDH1男性80岁之前罹患弥漫型胃癌的累积风险为70%、女性为56%。发生CDH1突变的胃癌患者病理检查以印戒细胞癌为多,目前针对CDH1突变携带者的治疗方式主要是预防性全胃切除。但该方法创伤大且效果差,相关CDH1靶向药物研究尚空缺。
2.6Ras同源基因家族成员A(RhoA)
RhoA定位于4q28.1,属于RAS亚家族成员之一。RHOA突变可促进弥漫性胃癌的发生,其在女性、远端胃癌、低分化胃癌(G3/G4)、T/T期以及无远处转移的患者中更为普遍。当RhoA基因在Y42点突变时,可与c-Met直接结合,促进胃癌的增殖和转移,患者预后差。在现有研究中,胃动蛋白1、miR-31、CD24均可靶向RhoA抑制肿瘤进展,其中miR-31靶向RhoA时可同时增加肿瘤细胞对5-氟尿嘧啶的敏感性。有关RhoA突变及其靶向机制还有待进一步研究。
胃癌中致癌基因与抑癌基因的相互调控作用
胃癌的致癌基因与抑癌基因存在相互作用,如图1所示。KRAS和RhoA共同调控RAS-RAF-MEK-胞外信号调节激酶信号通路,促进胃癌的发生与发展。PIK3-Akt-mTOR通路不仅参与了胃癌的发生发展,而且是肿瘤细胞对化疗药物产生耐药的主要通路。该通路中关键致癌基因ERBB2、PIK3CA或ERBB3的激活,在胃癌细胞的增殖和凋亡中发挥作用。除此之外,胃癌相关基因KRAS、TP53、FAT1和ERBB2的高表达增加了患者对幽门螺杆菌的易感性,从而增加了胃癌的患病风险。在EB病毒相关胃癌中,PIK3CA和ARID1A具有较高的突变频率,且两者呈负调控关系。
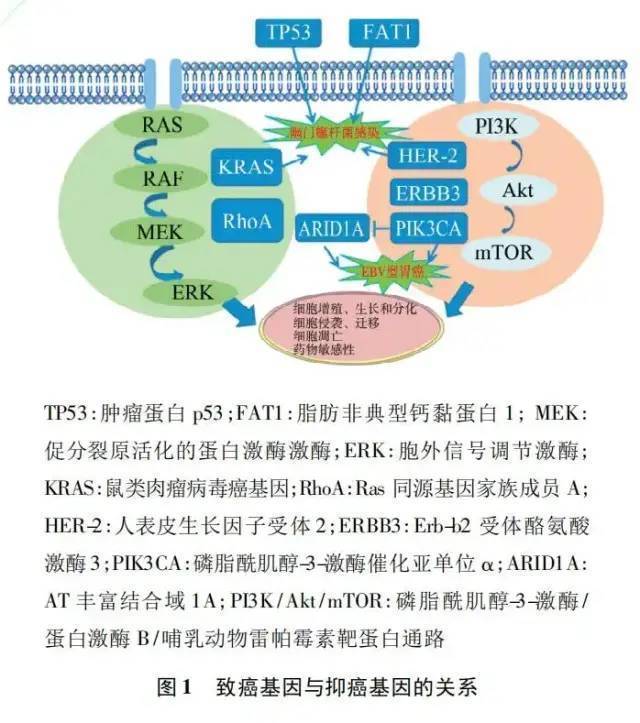
总结与展望
虽然生物信息学分析技术和精准医疗的发展推动了胃癌靶向治疗的进步,但目前研究还尚未成熟,仍需进一步探索以实现精准化和个体化治疗。部分基因(如ERBB3、FAT1、CDH1和RhoA)在胃癌治疗及耐药方面的研究比较缺乏。目前虽然与胃癌靶向治疗研究相关的基因众多,但只有ERBB2是美国国家综合癌症网络指南推荐的与胃癌治疗相关的基因。另外,单个基因的靶向治疗对胃癌的治疗效果并不理想,而多种胃癌基因的靶向药物联合可提高胃癌患者的生存率。因此,寻找新的胃癌治疗靶点以及关键基因之间的相互作用可能是急需攻破的难题。来源:IMICAMS 中国医学科学院医学信息研究所
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxNzc5MzUwNw==&mid=2247487890&idx=2&sn=6d3de44deb7420d3402eab21469eb15d&chksm=f993e21ecee46b083507fd4f9bb09940cd88b55abcae8dd4af3c5c1f9cef4a6af9cc3cf2033e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

实施“靶向治疗”,西部高教需部分先行?

基因合成产业未老先衰?
靶向CCR5治疗乳腺癌!
中国抗癌协会肿瘤靶向治疗专业委员会在京成立



NEJM:HER2阳性晚期胃癌死亡风险低40%!曲妥珠单抗偶联药物带来新希望

行业动态|复宏汉霖曲妥珠单抗HLX02获新药上市申请受理

纳米科技,离你我很近

【科普】靶向治疗,如何吃才效果最佳
靶向谷氨酰胺依赖,克服CDK4/6抑制剂耐受治疗食管鳞癌

研究证实德曲妥珠单抗对多种HER2表达晚期实体瘤有效