科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-22
来源:iNature
单粒子电子冷冻显微镜(cryo-EM)是解决生物大分子三维结构的有力方法。透射电子显微镜,检测器和自动程序的技术发展,加上用户友好的图像处理软件以及不断增长的计算能力,使cryo-EM在过去十年中成为成功且不断扩展的技术。在高于4Å的分辨率下,开始可以建立原子模型,但是直接可视化蛋白质结构确定真实原子位置需要更高的分辨率(优于1.5Å),而到目前为止,cryo-EM尚未实现。原子位置的直接可视化对于理解蛋白质催化的化学反应的机理以及研究药物如何结合和干扰蛋白质的功能至关重要。
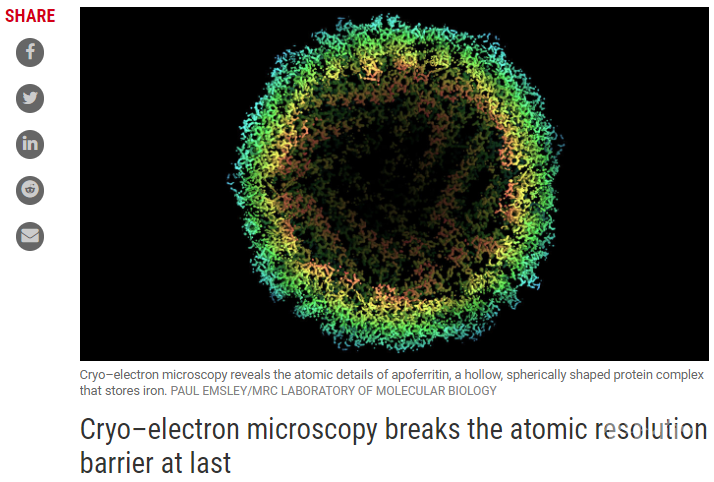
2020年10月21日,Ka Man Yip等人在Nature 在线发表题为“Atomic-resolution protein structure determination by cryo-EM”的研究论文,该研究报告了用冷冻-EM获得的1.25Å分辨率的脱铁铁蛋白结构,该结构提供了前所未有的结构细节。脱铁铁蛋白结构的3D信息含量几乎是当前世界纪录重建的两倍(1.54Å分辨率)。该研究可以可视化蛋白质中的单个原子,查看氢原子的密度并成像单原子化学修饰。除了名义上提高分辨率外,该研究还实现了冷冻-EM密度图质量的显著提高,这与在基于结构的药物设计中使用冷冻-EM高度相关。
2020年10月21日,Takanori Nakane等人在Nature 在线发表题为“Single-particle cryo-EM at atomic resolution”的研究论文,该研究使用新的电子源,能量过滤器和相机来获得人膜蛋白β3GABAA受体的1.7Å分辨率冷冻-EM重建。此类图谱可以详细了解小分子配位,溶剂分子的可视化以及多种氨基酸的替代构象,以及有序酸性侧链和聚糖的明确构建。该技术应用于小鼠脱铁铁蛋白后,获得了1.22Å分辨率的重建,该重建使单粒子冷冻EM提供了蛋白质分子的真实原子分辨率视图。而且,许多氢原子的散射电位可以在差异图中显示,从而可以直接分析氢键网络。该研究的技术进步与加速数据采集和改善样品质量的其他方法相结合,为在常规小分子调节剂高通量筛选和基于结构的药物发现中常规应用cryo-EM提供了一条途径。最后,2020年10月21日,Mark A. Herzik在Nature 发表题为“Cryo-electron microscopy reaches atomic resolution”的点评文章,系统介绍了这2项研究成果;Science 发表了题为“Cryo–electron microscopy breaks the atomic resolution barrier at last”的文章,对于该技术进行了报道。



结构生物学的一项基本原则是,一旦研究人员能够直接足够详细地观察大分子,就应该有可能了解其3D结构如何赋予其生物学功能。确实,许多科学进展都依赖于尽可能详细地直接观察我们周围的世界,并且越来越多的努力致力于可视化对人类疾病具有关键作用的生物成分的原子结构。核磁共振(NMR)光谱,X射线晶体学和冷冻电子显微镜(cryo-EM)是目前使用的三种主要结构生物学技术。在这三种方法中,cryo-EM已成为确定大型动态复合物结构的关键技术。
Yip等人和Nakane等人在Nature上发表文章,报道了使用称为单粒子冷冻EM的方法获得的最清晰的图像,这使得首次确定蛋白质中单个原子的位置成为可能。最终,这些进展将帮助研究人员以前所未有的分辨率更好地了解蛋白质在健康和疾病中的工作方式,并有可能帮助设计更好的疗法。
尽管cryo-EM是一项已有数十年历史的技术,但由于一系列技术和算法方面的进步共同推动了该技术可获得的分辨率的显著提高(称为“分辨率革命”),因此自2013年以来,它已引起了越来越多的关注 。
cryo-EM的分辨率革命在继续前进。Yip等人和Nakane等人利用技术改进来确定称为铁蛋白(在没有金属的情况下称为载铁蛋白)的结构,其分辨率约为1.2Å。这些结构是迄今为止确定的最高分辨率的单粒子冷冻EM重建,并且数据的质量足以分辨载铁蛋白中的单个原子。
Yip及其同事的成功依赖于硬件的进步,包括诸如球差校正器和采用一系列滤光片的单色仪装置之类的组件,以确保只有能量分布较窄的电子才能与样品相互作用,从而提高了分离度及最终的图像。Nakane和他的同事应用了另一种技术,一种冷场发射枪,它还产生能量分布较窄的电子, Nakane等人使用下一代高度灵敏的电子检测相机捕获数据。
除了分析载铁蛋白外,Nakane及其同事还获得了1.7Å分辨率的A型γ-氨基丁酸(GABAA)受体的结构,该受体是一种蛋白质复合物,存在于神经元的细胞膜中,是许多治疗方法的靶标。对于这样的生物样品,通过单颗粒冷冻EM获得如此高的分辨率几乎被认为是不可能的,该结构揭示了以前从未见过的GABAA受体的细节,例如,提供了深入了解蛋白质核心中称为组胺的分子的结合的信息。
但是,这些技术代表了冷温EM仪器的尖端水平,由于购买和操作成本,目前对于大多数机构来说都是遥不可及的。展望未来,这些类型的进步将帮助我们更多地了解限制可达到的分辨率的因素,因此可能使设计更好的仪器成为可能。尽管这样的高分辨率结构并不是回答每个生物学问题所必需的,但此类硬件可以提供的额外细节将限制3D结构中的不准确性,并为理解生物学功能提供更好的平台。因此,尽管cryo-EM的分辨率革命可能已接近尾声,但未来几年仍在等待更多的革命,这将使这项技术更加强大,并适用于研究各种生物学问题。
来源:Plant_ihuman iNature
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247516542&idx=4&sn=99e030b2996404cfeee6984ed9881d95&chksm=fce6f2a1cb917bb78a2a140bf0301886f50fab92bf319051d6dccb61851c5c8d271ac4dc817a#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科学家解析猕猴大脑微米分辨率三维结构
人源V-ATPase高分辨率结构

人体细胞内存在“铁路”系统,能自动优化结构

新型机器人可编织玻璃纤维结构

静力试验中C/SiC构件集成式热结构的声发射特性及与材料测试的对比
阿贝分辨率

【复材资讯】形状记忆聚合物微纳米纤维膜在生物医学中的应用进展
【复材资讯】科学家首次实现陶瓷4D打印
光学分辨率

电子显微镜分辨率突破了世界纪录