科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-12
来源:CBG资讯
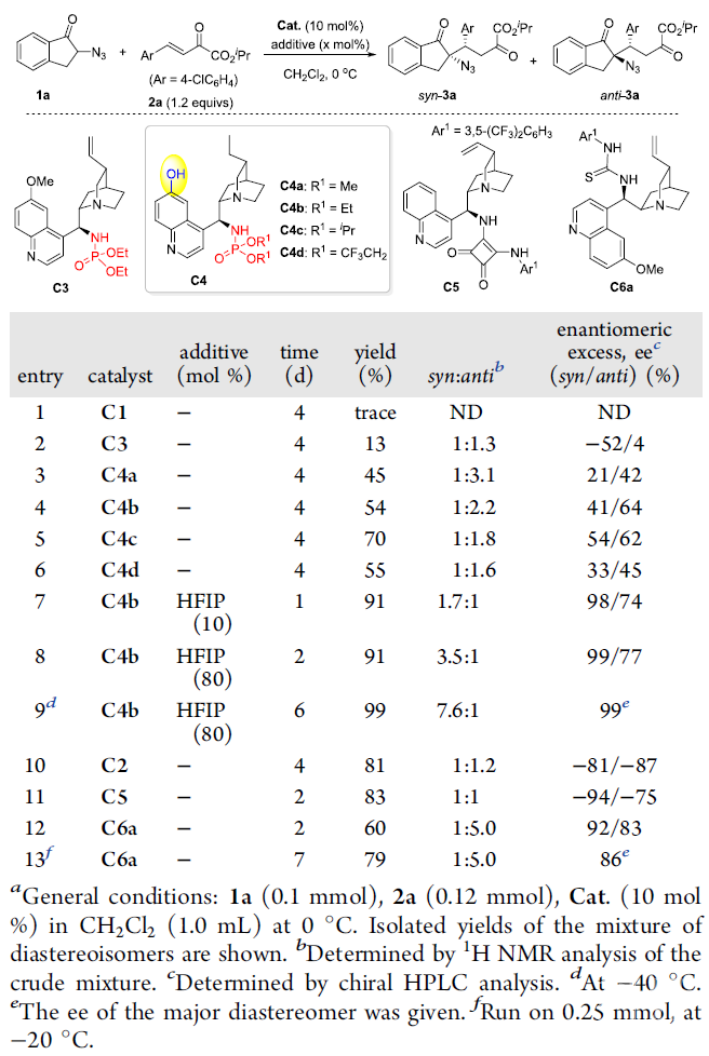
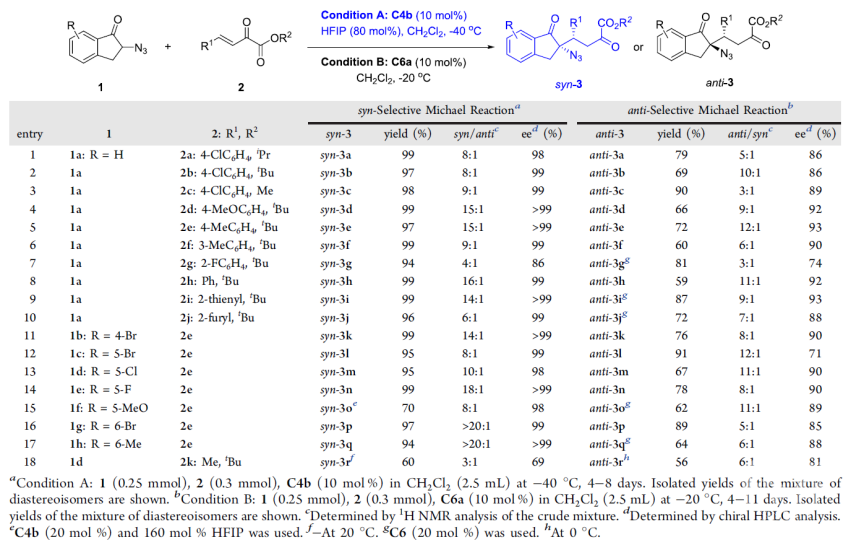
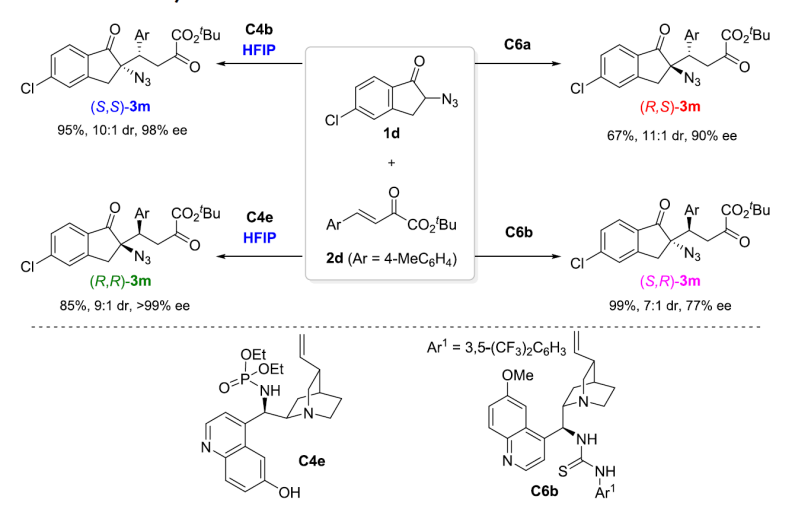
导语α-手性叠氮结构单元不仅存在于许多药物或生物活性分子中,还是一类广泛用于合成α-手性胺或α-手性三/四氮唑等含氮化合物的重要砌块。过去几十年,α-手性叠氮化合物的不对称催化构建受到了越来越多的关注,但主要集中在α-手性二级叠氮的合成,而更具挑战的手性三级叠氮的研究则较少,其立体发散性合成还未见报道。直到2020年,华东师范大学周剑教授课题组利用叔胺-氢键给体催化剂催化的α-叠氮酮与硝基烯烃的不对称Michael加成反应首次实现了α-手性三级叠氮的立体发散性合成(Chem. Sci., 2020, 11, 3852)。近日,他们在这一领域取得了新的进展(Org. Lett., 2020, DOI: 10.1021/acs.orglett.0c03178)。 周剑教授课题组简介周剑教授课题组运用“协同活化”的理念,采用“双功能催化”和“多种催化剂协同催化”这两种实现协同效应的策略致力于“具有四取代碳手性中心的不对称催化构建”。相关研究工作发表在J. Am. Chem. Soc.; Angew. Chem. Int. Ed.; Nat. Commun.; Chem. Sci.等国际知名期刊上。教授简介 周剑,华东师范大学化学与分子工程学院教授,博士生导师。本科毕业于四川师范大学;2004年毕业于中科院上海有机所,获理学博士学位;先后在日本东京大学Shu Kobayashi和德国马普煤炭研究所Benjamin List课题组从事博士后研究,于2008年底加入华东师范大学。研究兴趣在于立足协同催化的理念,结合新催化剂和新试剂的设计开发,发展导向具有手性季碳的药物优势骨架的不对称催化构建新方法。他获得的奖项包括:教育部“新世纪优秀人才支持计划”(2011年);国家自然科学基金委优秀青年基金资助(2012年);上海市优秀学术带头人(2013年);Fellow of Royal Society of Chemistry(2014年);The CSJ Asian International Symposium Distinguished Lectureship Award(2015年);国家自然科学基金委杰出青年基金资助(2017年);科技部“中青年科技创新领军人才”(2018年)等。前沿科研成果催化不对称Michael加成反应实现α-手性三级叠氮的立体发散性合成α-手性叠氮不仅是许多药物或生物活性分子中的结构单元,还是一类合成α-手性胺或α-手性三/四氮唑等含氮化合物的重要砌块。过去几十年,虽然不对称催化合成α-手性二级叠氮取得了相当大的进展,但手性三级叠氮的不对称催化构建仍面临很大的挑战,相关报道较少(Org. Chem. Front. 2018, 5, 1542)。 另一方面,从相同起始原料出发,通过改变手性催化剂或反应条件来实现对手性中心化合物的立体发散性合成已经取得长足进展,但该策略很少用于手性叠氮化合物的立体发散性合成(图1)。2015年,Shibasaki课题组发现在手性铜催化的邻位取代苯甲醛与α-叠氮基-7-氮杂吲哚啉乙酰胺的不对称aldol反应中,改变手性配体可有效获得目标α-手性二级叠氮的两个非对映异构体(Angew. Chem., Int. Ed. 2015, 54, 6236)。随后,华东师范大学周剑教授课题组在有机催化的α-叠氮基酮与硝基烯烃的不对称Michael加成反应中,首次通过改变手性双功能胺催化剂上的氢键给体类型实现了α-手性三级叠氮的非对映选择性合成(Chem. Sci., 2020, 11, 3852)。最近,他们进一步利用α-叠氮茚酮与β,γ-不饱和-α-酮酸酯的不对称Michael加成反应实现了α-手性三级叠氮的立体发散性合成。值得一提的是,在该反应中,添加剂六氟异丙醇(HFIP)的加入对调控手性膦酰胺-叔胺催化的顺式立体选择性至关重要。 图1. 立体发散性合成α-手性叠氮化合物的反应(来源:Org. Lett) 经过条件优化,作者发现1a和2a的模板反应在10 mol%新设计合成的金鸡纳碱衍生的叔胺-膦酰胺-酚羟基双氢键给体双功能催化剂C4b和80 mol%的添加剂HFIP作用下,可高效高选择性获得顺式加成产物syn-3a;而在10 mol% 奎宁定衍生的硫脲C6a催化下,则以良好的立体选择性获得反式加成产物anti-3a(表1)。 表1. 条件优化(来源:Org. Lett) 接下来,作者对底物普适性进行考察,发现不同取代的酮酸酯和叠氮茚酮在两种催化体系下均有很好的兼容性,能以良好到优秀的产率,dr和ee值分别获得相应的顺式或反式α-手性三级叠氮茚酮衍生物(表2)。 表2. 底物适用范围研究(来源:Org. Lett) 值得一提的是,从相同的起始原料出发,仅通过改变手性催化剂即可实现手性α-叠氮茚酮3m的所有四种非对映异构体的合成(图2)。 图2. 3m所有四种非对映异构体的合成(来源:Org. Lett) 此外,产物的克级规模合成以及衍生化合成手性螺氮杂环(如螺环吡咯和脯氨酸衍生物)进一步证明了该方法的实用性(图3)。 图3. 方法的实用性(来源:Org. Lett) 这一工作近期发表在Org. Lett.上(Org. Lett., 2020, DOI: 10.1021/acs.orglett.0c03178),论文的第一作者为丁佩刚博士,通讯作者为周剑教授和余金生研究员。上述研究工作得到了国家自然科学基金委,上海市科技创新行动计划等项目的支持。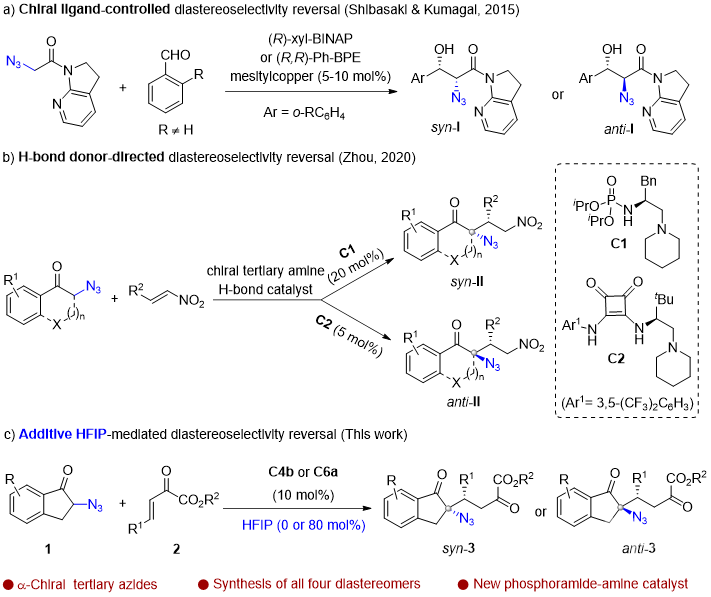

来源:BeanGoNews CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247513045&idx=1&sn=bc8278e1650dce33d7bec50bdb8427e2
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

今日科技话题:4000米深海自持式剖面浮标海试成功、家庭社会地位影响儿童多动症发病率、首次实现陶瓷4D打印、解析金刚鹦鹉起源
固化催化剂

微纳电池催化剂:一类新型高效集成催化剂体系

分子催化剂接枝在固体表面的新型复合催化剂
贵金属催化剂回收

科学家证实:单个铂原子可催化CO转化为CO2
固体催化剂

利用手性氢键催化在吲哚的碳环上引入轴手性——新型手性联芳基酚类催化剂的合成
能源催化剂
催化剂载体