科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
范特霍夫因子(英语:Van 't Hoff factor)表示溶质对溶液依数性性质(如渗透压、蒸汽压下降、沸点升高和凝固点降低)影响的程度。
简介范特霍夫因子 i(英语:Van 't Hoff factor)(以荷兰化学家范特霍夫命名)表示溶质对溶液依数性性质(如渗透压、蒸汽压下降、沸点升高和凝固点降低)影响的程度。范托夫因子是已溶解的物质产生的实际微粒浓度,和根据其质量所计算得出的浓度的比值,因而是无量纲的。1
对于大多数溶解在水中的非电解质,范托夫因子数值是1。对于大多数溶于水中的离子化合物,范托夫因子等于该物质单位化学式(Formula unit)中所含独立离子个数,如KCl是2,Ca(OH)2是3;这仅在理想溶液中成立,因为离子缔合(Ion-association)现象很少发生。在特定的瞬间,一小部分离子会配对在一起,因而被计为一个微粒。这种离子缔合现象在任何电解质溶液中都会不同程度的发生,导致了与范托夫因子与实际间的偏差。这种偏差在离子有多重化合价(multiple charges,如铜、铁)时会达到最大。
溶质解离溶质解离度是溶解于溶液中的溶质分子的比例。它通常用希腊字母阿尔法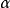 表示。这一系数和范托夫因子之间的关系很简单;如果
表示。这一系数和范托夫因子之间的关系很简单;如果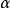 比例的溶质解离为了 n个离子,那么,
比例的溶质解离为了 n个离子,那么,
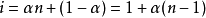
例如,如下的电离方程,
KCl ⇌ K++ Cl-
产生了n=2个离子,所以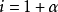 。
。
溶质缔合类似的,如果n摩尔的溶质中以 比例缔合形成一个一摩尔微粒,那么
比例缔合形成一个一摩尔微粒,那么

例如,乙酸在苯中的二聚作用,
2CH3COOH ⇌ (CH3COOH)2
两摩尔的乙酸缔合形成一摩尔物质,所以,

物理意义若溶质微粒在溶液中缔合, i值小于1,。例如各类羧酸或苯甲酸在苯中形成的二聚体,所以实际溶解的溶质微粒数是酸分子数的一半。
若溶质分子在溶液中离解,i值大于1。例如氯化钠、氯化钾、氯化镁等强电解质溶于水中。
若溶质分子在溶解中既不离解也不缔合,i值便等于1,例如葡萄糖溶于水中。
i值等于:i = 实际溶解的微粒数 ÷ 最初投入溶剂的微粒数。这表示平均算来,在稀溶液中,每单位化学式所溶解的微粒数。
范特霍夫方程范特霍夫方程(Van 't Hoff equation)是一个用于计算在不同温度下某反应的平衡常数的方程。设 K 为平衡常数, ΔH为焓变, ΔS为熵变, T为温度。由雅各布斯·亨里克斯·范托夫提出。

或者写为
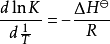
如果假设反应焓变在不同温度下保持恒定,则在不同温度 T1和 T2下,等式的定积分为
 这里 K1是在绝对温度T1下的平衡常数, K2是在绝对温度T2下的平衡常数。 ΔH是标准焓变,R 是气体常数。
这里 K1是在绝对温度T1下的平衡常数, K2是在绝对温度T2下的平衡常数。 ΔH是标准焓变,R 是气体常数。
参见依数性
拉乌尔定律
范托夫方程
渗透压
本词条内容贡献者为:
曹慧慧 - 副教授 - 中国矿业大学