科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-11
来源:X一MOL资讯
秋天的干净阳光下,一阵微风吹过银杏树,满眼都是跃动的金色……

这一画面,应该就代表着不少人心中的“金秋”。面对如此美景,诗兴大发?挥毫泼墨?不不不,笔者还是谈谈与银杏有关的老本行吧——近期发表在Nature 上的银杏新内酯bilobalide的不对称合成。
银杏不但看起来很美,在传统中医理论中还被认为具有抗衰老的功效。银杏提取物中的bilobalide是活性成分之一,有研究表明其可以拮抗γ-氨基丁酸A受体(GABAAR)而具有保护中枢神经系统的作用,例如在唐氏综合征小鼠模型上表现出降低认知损伤的效果。但由于bilobalide在银杏叶和根皮中含量极低,又尚未被发现存在于其他植物中,这给提取纯化带来了很大难度。此外,bilobalide超级拥挤的立体结构和不稳定性也给合成带来了极大的挑战,因此对除GABAAR外的靶点研究及药用开发受到很大限制。截止到目前,只有两个课题组完成了bilobalide的全合成,分别是1988年哈佛大学E. J. Corey教授课题组以24步完成其对映选择性合成(Tetrahedron Lett., 1988, 29, 3423);1993年北卡罗来纳大学的Michael T. Crimmins教授课题组以17步完成bilobalide的消旋体合成(J. Am. Chem. Soc., 1993, 115, 3146)。两者共同的特点是通过8-11步氧化还原操作去构筑高度取代的环戊烷母核。很显然,这种操作在整个路线中占了很大比重,要想进一步缩短合成路线,满足氧化还原经济性是一种重要的策略。
近日,美国斯克里普斯研究所(The Scripps Research Institute, TSRI)的Ryan A. Shenvi教授和Masaki Ohtawa教授通过创造性的思维,认为bilobalide可以看作是一个假对称(pseudosymmetric)的稠合双内酯分子(下图),可以通过对化合物5的C10位后期的氧化来构筑,而5的合成最终可以从对称的合成子二酯开始。如此,他们仅用10步就高效完成了(-)-bilobalide的不对称合成,其中仅涉及3步氧化还原反应,而前9步仅需要1个人在7天时间内就能完成,可得到0.35 g的5。相关工作发表在Nature 上。
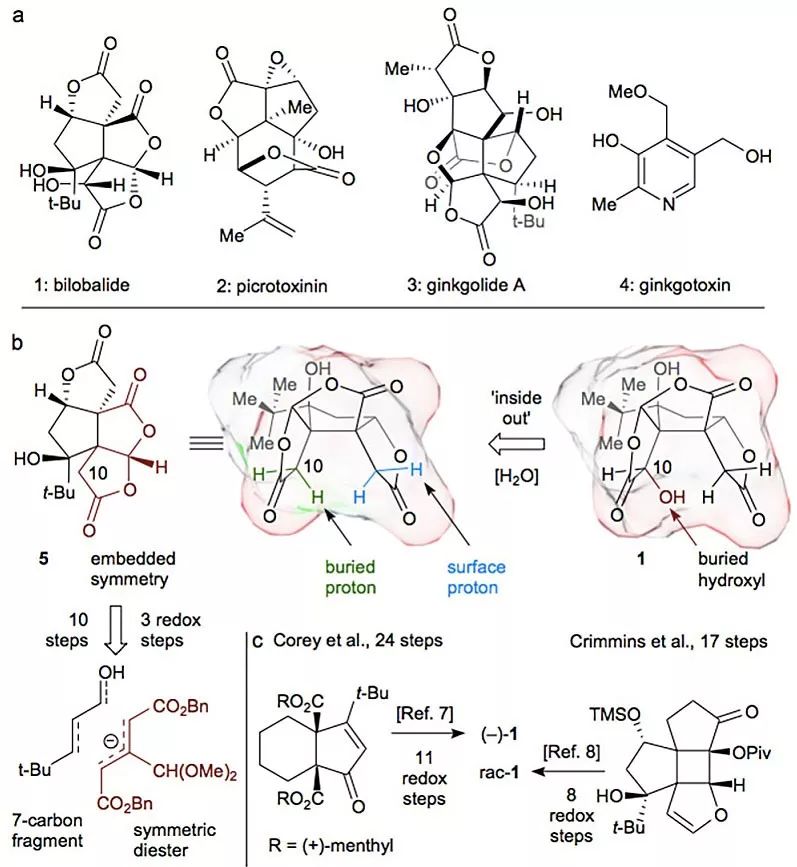
各种银杏内酯和bilobalide的合成考虑。图片来源:Nature
先谈一点笔者的读后感。整篇文章我认为可用一个关键词总结,那就是“挑战”,这个词几乎贯穿了这条“简洁而不简单”的合成路线中。当然,全合成就像打怪闯关一样,想要最后成功,就要征服所有大大小小的挑战。
首先,起始步骤就是第一个挑战(下图)。作者想要实现的是以6a和6b为底物进行的不对称Reformatsky反应,因为像7这类的化合物通常在碱性条件(如采用aldol缩合)下很可能发生逆aldol反应,因此Reformatsky反应是最可靠的选择。然而,另一个不大不小的挑战又被引出,文献里并没有同时具有对映和非对映选择性的Reformatsky反应可参考,只有一篇Wolf等人用噁唑烷作为配体的对映选择性Reformatsky反应(J. Org. Chem., 2011, 76, 6372)。经过配体筛选,作者发现双噁唑配体indabox (‒)-A可以以97:3的er 值得到syn-构型的产物7(2.3:1 dr)。接着在自由基条件下发生Giese-type 5-exo-trig环化反应构筑第一个手性季碳,得到环戊烯8(20:1 dr)。
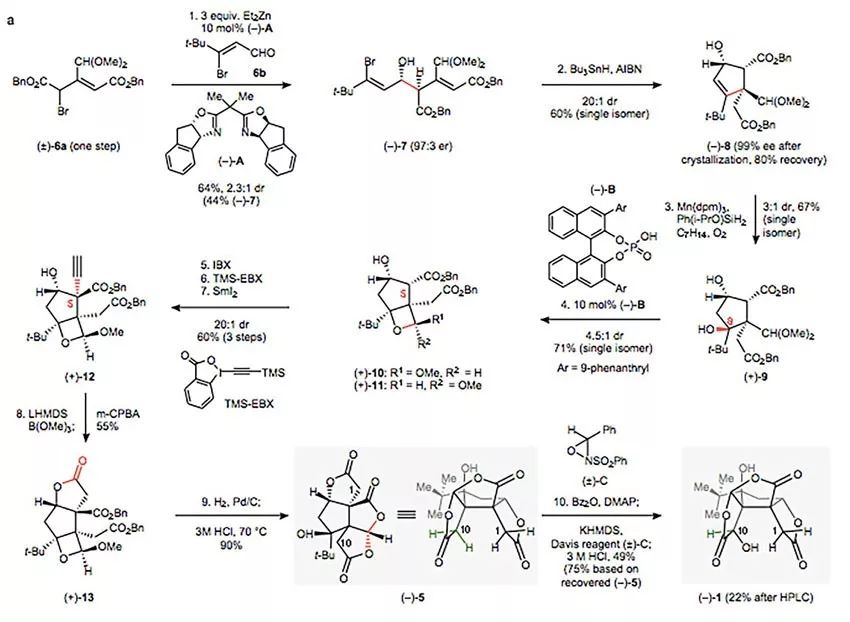
Bilobalide全合成路线。图片来源:Nature
第二个手性季碳的构筑就没那么容易了,即C8位羟基的引入给合成带来了第二个挑战。作者首先想到了Drago-Mukaiyama水合反应,但在标准的金属氢化物氢原子转移(MHAT)条件下9的收率很低且没有非对映选择性。根据他们以往的研究,硅烷醇解后的产物烷氧基硅烷(如Ph(i-PrO)SiH2)可以作为大多数Mukaiyama反应中动力学上相关的还原剂,对于降低催化剂用量及反应温度、提高官能团兼容性有奇效。因此,他们用Ph(i-PrO)SiH2作为氢源进行环戊烯8的水合研究,发现金属催化剂上的配体对反应的非对映选择性无影响,而溶剂的极性则影响了非对映选择性,例如当甲基叔丁基醚作为溶剂时,得到的是以(S)-构型为主的C8非对映异构体,而甲基环己烷则主要得到需要的(R)-C8构型的产物9(3:1 dr),作者猜想可能是分子间氢键作用的影响。
接下来的氧杂环丁烷的构筑是第三个挑战(下图)。在强酸PTSA条件下,9得到两个差向异构混合物10(endo-OMe)和11(exo-OMe),不幸的是,想要的构型10是少量的,且11并不能在碱性条件下异构化为10。不过作者很聪明也很细心,他们发现这个氧杂环丁烷形成过程中是存在一定的动力学拆分现象的,因此想到也许使用恰当的手性酸可以进一步提高非对映选择性。最终他们以催化量的手性联萘酚磷酸酯(-)-B作为催化剂实现了这一过程。
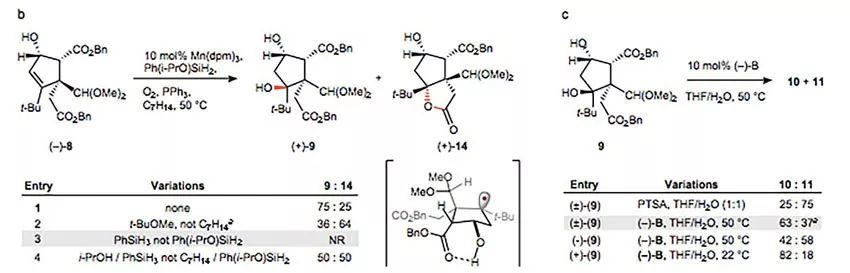
战胜第二、三个挑战。图片来源:Nature
然后是第一个内酯环的构筑,也是作者面临的第四个挑战。由于10的位阻效应,作者采用了一个三步的连续操作去构筑C5位的C-C键:被IBS氧化成β-酮酯;接着用Waser试剂(TMS-EBX)进行亲电炔基化后用TBAF脱除TMS保护;随后在THF/H2O混合溶剂的条件下,使用SmI2进行还原,三步反应以60%的收率得到12。炔烃通过发生反马氏水合反应与C6位羟基形成内酯环。然而,炔烃水合过程并不顺利。起初用过氧叔丁基锂等经典的条件直接氧化并未成功。作者便采取“曲线救国”的方式先用LiHMDS拔氢后与硼酸三甲酯反应生成炔基硼酸酯中间体,再用m-CPBA氧化并自发关内酯环得到13,这也是首次报道的采用此法氧化炔烃的例子。13经过氢解脱苄基保护后发生骨架重排便得到前文所设计的假对称化合物5。
看上去离成功只一步之遥,然而C10位后期区域和立体选择性氧化成了该全合成工作中第五个挑战,因为碗状分子5不仅拥有三个酸性位点(羟基、内侧及外侧的内酯),且在碱性条件下还不太稳定,例如在-78 ℃下加入3当量的强碱接着用酸淬灭就会导致5分解。作者发现加入1当量KHMDS后接着用1M HCl淬灭则会发生分子内转内酯化生成16a(下图),通过分子模型分析,认为这是由于C8羟基进攻C4在Bürgi-Dunitz 角范围内以及生成的16a上内酯π电子与相邻的C-O键 σ∗轨道形成反馈键从而使构象更稳定这两种因素共同作用的结果。另外,作者还发现此时原来处于内侧的C10氢发生了翻转,变得相对容易接近,转化为TBS醚16b也有类似现象,但可惜16b在碱性条件下只有6%转化为1。最终,作者发现将5转化为苯甲酸酯后,内侧的内酯环C10氢进一步暴露,酸性也增强,在KHMDS作用下形成的烯醇可以被稳定,从而被Davis试剂氧化完成bilobalide的全合成。
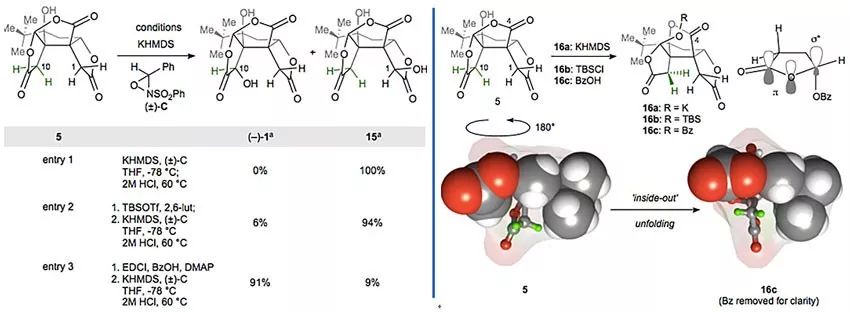
后期区域和立体选择性氧化C10位。图片来源:Nature
金秋正是银杏最美的时节,Ryan A. Shenvi和Masaki Ohtawa等人这篇关于银杏新内酯bilobalide的高效不对称合成刚好应景。整个合成路线简洁巧妙,背后则是“步步惊心”的诸多挑战,而他们的应对又充分展示了扎实的合成功底和充满创造性的思路,让人体会到了不逊于金秋美景的化学之美。当然,“美”只是化学的一面。杜甫七律之首的《登高》有这么一句“无边落木萧萧下,不尽长江滚滚来”,描写诗人在夔州长江之滨登高所见之秋景,笔者不知道他看到的是不是银杏随风飘落,但于从事全合成的人而言,这一路真是如诗中所说“艰难苦恨繁霜鬓”。这简洁的全合成,背后藏着多少辛酸和孤寂,可能只有作者自己清楚。美与艰难纠缠在一起,这也许就是全合成被称为有机合成“艺术”的原因之一吧。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657622864&idx=1&sn=d215d353028dd30965a252c4e1d6937f&chksm=80f83280b78fbb966ea4606470011866c721ccf970ed799cb3c6215bdd922d886f03a53c3663&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

我国科学家在聚酯生物医用材料合成领域取得新进展
丁位己内酯

PNAS|李家洋研究组在水稻独角金内酯与细胞分裂素间的调控机理取得新进展
螺内酯试验

抗癌天然产物“防风草内酯骨架”首次高效合成

一个月内天然产物全合成再登《Nature》:银杏叶中白果内酯的高效不对称合成
DL-异柠檬酸内酯
遗传发育所揭示水稻独角金内酯与细胞分裂素间的调控机理
D-葡萄糖醛酸内酯
葫芦巴内酯