科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-18
来源:植物生物学
在自然环境中植物经常面临各种非生物胁迫。其中,热胁迫对植物发育、生长、繁殖和产量等方面都有不利影响。植物的热激蛋白(HSPs)包括HSP70、90和101等,它们作为分子伴侣,保护细胞蛋白免受不可逆的热诱导变性,并促进热损伤蛋白的复性。
2020年12月29日,南京农业大学张群教授课题组在著名期刊Plant Physiology发表题为“HSP70-3 Interacts with Phospholipase Dδ andParticipates in Heat Stress Defense”的学术论文。该研究揭示了热激蛋白HSP70-3通过与磷脂酶PLDδ相互作用,参与植物的热胁迫响应过程。

为了探究HSP70-3的功能,研究者筛选该基因的T-DNA插入突变体以及获得其过表达植株。HSP70-3基因的缺失导致热应激3小时后突变体植株的高敏感性表型;而与WT幼苗相比,过表达植物表现出更强的抗逆性。组织水平表达结果显示该基因主要在叶片和根中表达,并且在保卫细胞中的表达量非常高。
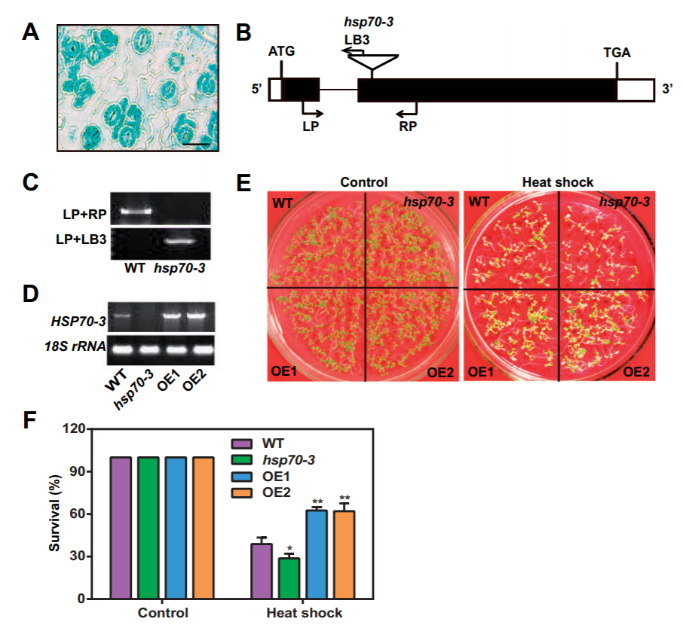
图:HSP70-3的T-DNA插入突变体、表达模式和表型鉴定
前人研究报道,在本氏烟草花粉管中,线粒体定位的HSP70与微管结合并与驱动蛋白相互作用。因此,研究者想要探究HSP70-3是否也与微管相互作用。体外共沉积实验证实HSP70-3与微管相互作用。使用mCherry及GFP分别标记HSP70-3及微管MARKERTUA6蛋白,证实两者存在部分共定位。
前人研究报道,HSP70能够与磷脂酶PLDδ相互作用。为了对此进行验证,研究者使用PULL-DOWN、BiFC以及Co-IP实验证实HSP70-3与磷脂酶PLDδ之间的相互作用。并且证实Arg622为两者相互作用的关键位点。
Co-IP分析结果显示,热处理条件下,PLDδ能够招募更多的HSP70-3蛋白,使其定位于质膜上与PLDδ相互作用。功能分析显示HSP70-3抑制PLDδ的活性,介导微管重组、磷脂代谢和植物耐热性等过程。
综上所述,HSP70-3和PLDδ之间的相互作用有助于在植物应对外部胁迫时重建细胞稳态,并揭示了植物调节膜脂代谢的新机制。
来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247494912&idx=1&sn=f5ba1d03a6bc3a4999b7259a6e574634
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

华中农大在柑橘优异资源非生物胁迫应答研究获新进展

朱健康院士综述植物非生物胁迫信号转导
STOP1通过调控植物细胞pH稳态响应非生物逆境胁迫的分子机理

华中农业大学刘继红团队在柑橘优异资源非生物胁迫应答研究中取得新进展

硫化氢在植物适应非生物胁迫中的生理功能及作用机制
昆明植物所在非生物胁迫如何影响植物动态光合效率方面获进展

朱健康院士等综述植物非生物胁迫信号转导,为培育抗逆作物提供思路

Cell 朱健康院士综述植物非生物胁迫信号转导

段成国课题组发表综述“植物非生物胁迫的表观遗传调控机制”

综述:非生物胁迫如何影响生物胁迫