科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-19
来源:CBG资讯
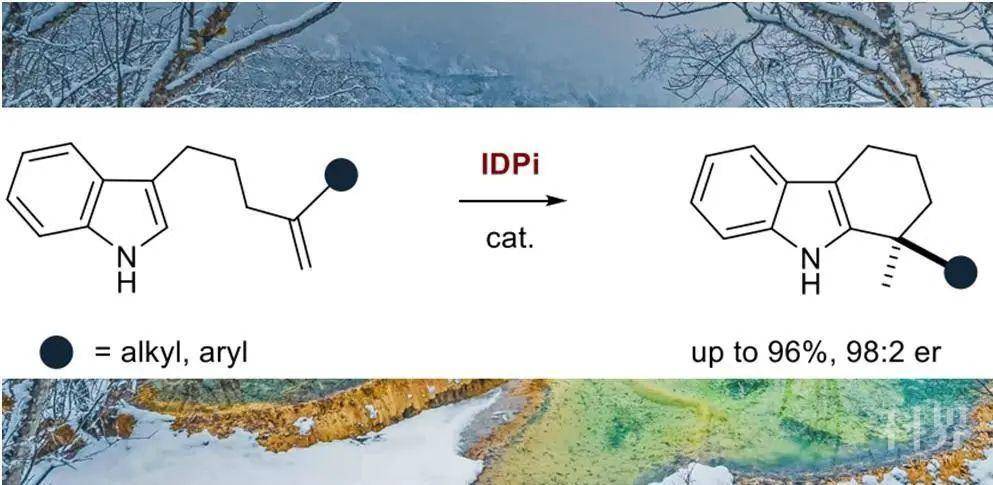
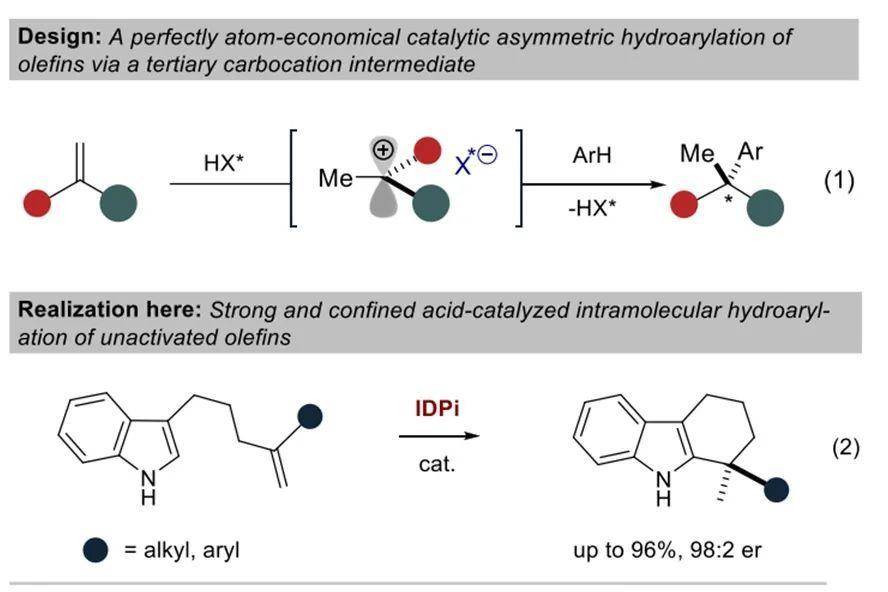
在构建苄位手性季碳的方法中,一种简洁且原子经济性高的方式是通过1,1-二取代烯烃的质子化形成三级碳正离子,随后经不对称芳基化来构建手性季碳。然而,这类转化至今没有实现。虽然非活化烯烃的催化氢芳基化反应具有百万吨级的实际应用价值,但是这类反应的不对称版本仍旧处于发展初期。在之前的报道中,有机小分子催化剂可以实现活化烯烃及芳烃的不对称芳基化反应,金属催化剂实现不对称芳基化则大多依赖于共价结合的导向基团的作用。在最近几年的报道中,Widenhoefer、Peters和Cramer课题组分别实现了Pt或Ni催化的吲哚化合物的不对称芳基化,Hartwig和Meek课题组也分别报道了Ir和Rh催化的分子间不对称芳基化反应,但反应底物局限于降冰片烯和1-芳基丁二烯。
迄今为止,利用非活化烯烃的氢芳基化过程实现手性季碳的构建仍旧是一个具有挑战性的课题。德国马克斯·普朗克煤炭研究所的Benjamin List课题组最近报道了亚氨基二膦酰亚胺(IDPi)催化的非活化烯烃的马氏氢烷氧基化反应。在这些研究的基础上,该课题组最近报道了非活化烯烃与吲哚的不对称分子间氢芳基化反应,可用于构建手性四氢咔唑骨架。相关研究成果发表在J. Am. Chem. Soc.上。
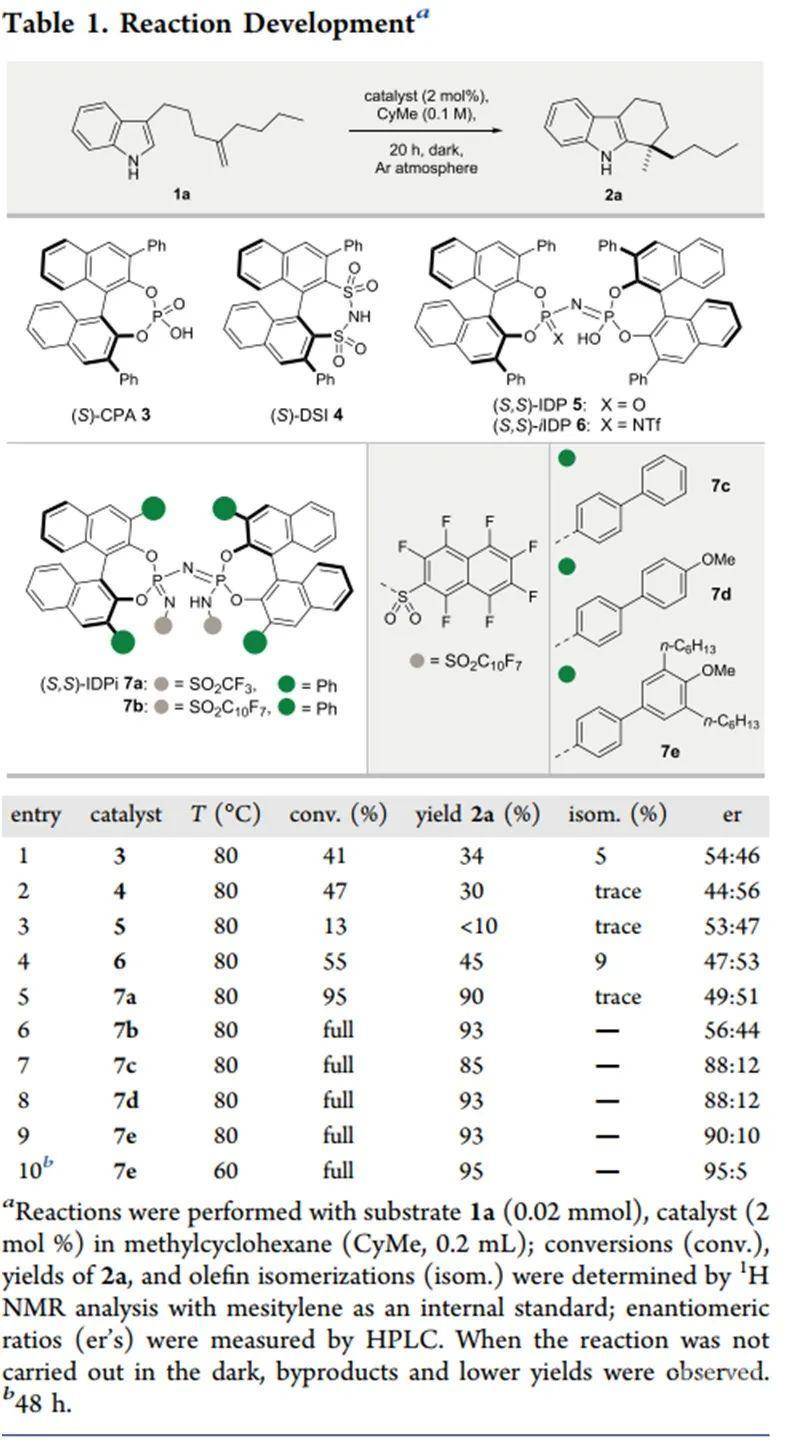
首先,作者采用1,1-二取代烯烃1a为模板底物进行条件优化(Table 1)。通过对布朗斯特酸等反应条件的优化,作者确定了反应的最优条件为:7e为催化剂、CyH为溶剂,底物于60 ℃反应2天,最终可以95%的收率与95:5的er值得到目标产物。
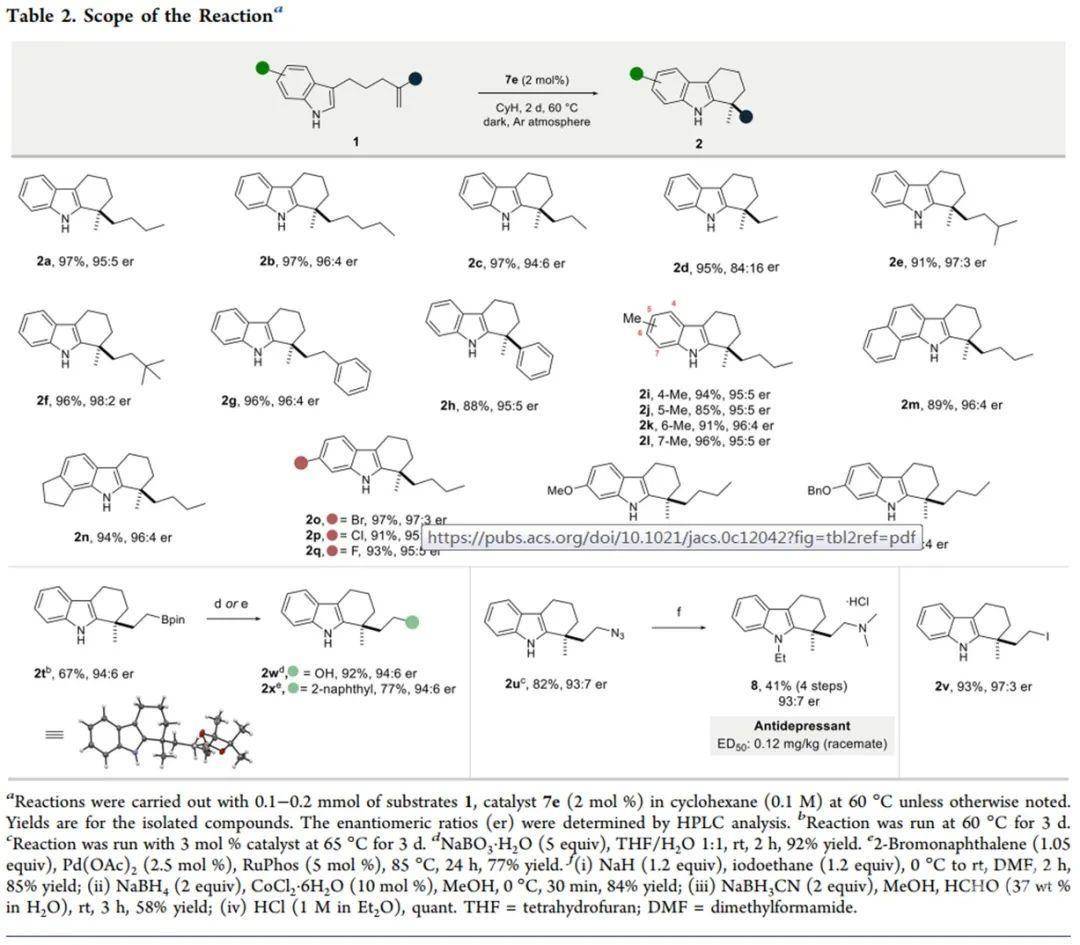
确定最优条件后,作者随后对反应的一般性进行了考察(Scheme 2)。其中,底物的位阻及电性效应均不会对反应产生影响,底物中的烯烃可以为烷基烯烃或芳基烯烃。反应具有良好的官能团耐受性,卤素、Bpin、N3等基团均可以兼容反应条件。值得一提的是,产物中的Bpin基团可以经氧化生成羟基或经Suzuki反应实现芳基化,产物中的N3基团可以经还原/还原胺化实现抗抑郁药的手性合成。
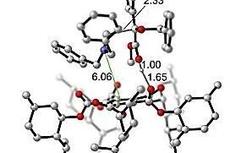
随后,作者通过控制实验说明了吲哚的NH基团对于反应的立体选择性控制具有重要作用。通过经相应机理实验,作者认为反应经过了六元螺环中间体,并提出了相应的反应机理:1)首先底物在酸性催化剂作用下实现质子化,生成离子对中间体I;2)随后吲哚对碳正离子进行亲核进攻生成螺环中间体;3)最后经烷基迁移、质子转移过程生成最终产物。
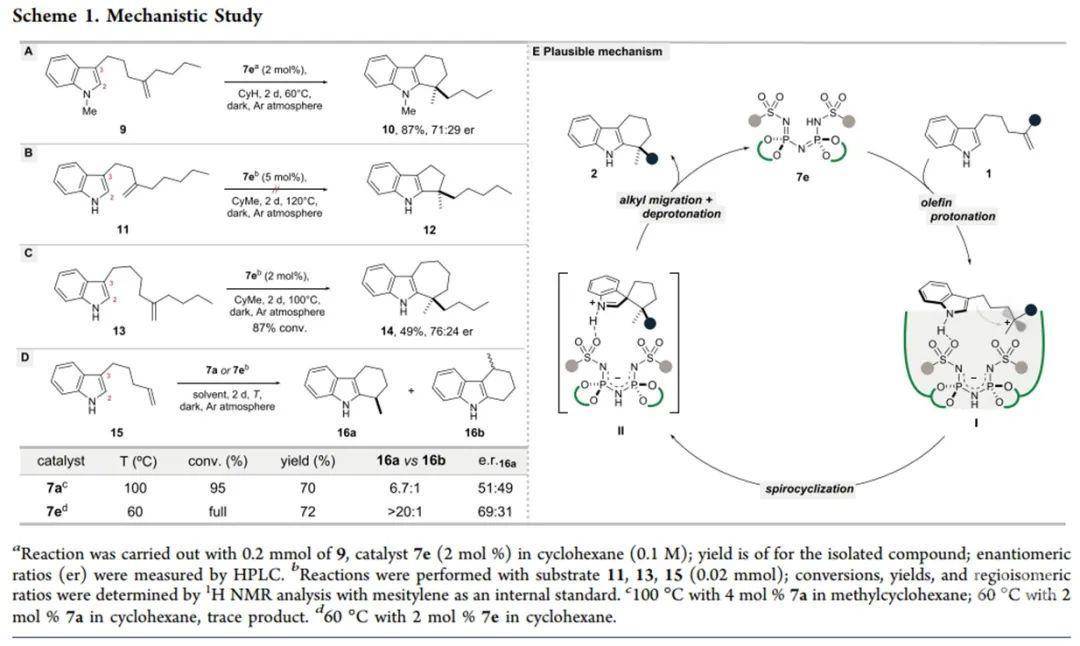
小结:Benjamin List课题组发展了一种原子经济性高、立体选择性好的分子间不对称氢芳基化反应,可实现吲哚与非活化烯烃的C-C成键,用于构建手性四氢咔唑骨架。
来源:BeanGoNews CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247518202&idx=2&sn=d3f3d30d960615aa4a67895bd5101a13
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Angew: 具有手性季碳中心烯丙基砜结构的选择性构建
JACS:亚磺酰亚胺的不对称合成——亚磺酰胺的芳基化反应
上海科技大学杨晓瑜课题组实现含β-吲哚手性季碳中心环戊酮的不对称合成

通过化学选择性的α-氧化磺酰化实现了酰胺的直接不对称芳基化

含季碳手性中心的顺式-氢苯并呋喃的对映选择性合成并应用于(-)-吗啡全合成
钴催化不对称[2+2+2]环加成反实现带有手性季碳中心的吡啶的对映选择性构建
“老(铑)当益壮”:“贵(硅)人相助”一步构建季碳和硅连碳手性中心

大连化物所利用铜催化的三组分反应构建手性季碳氨基酸酯
手性阴离子催化的不对称氨甲基化反应构建α-季碳-α-羟基-β2-氨基酸衍生物
福建物构所房新强课题组在手性季碳分子制备新策略研究中取得进展