科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-01-19
来源:植物生物学
免疫共沉淀(Co-Immunoprecipitation,CoIP):以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的方法。
原理
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。 如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。可用于检测两种已知蛋白间相互作用,也可于寻找某种特定蛋白的相互作用组分(质谱)。
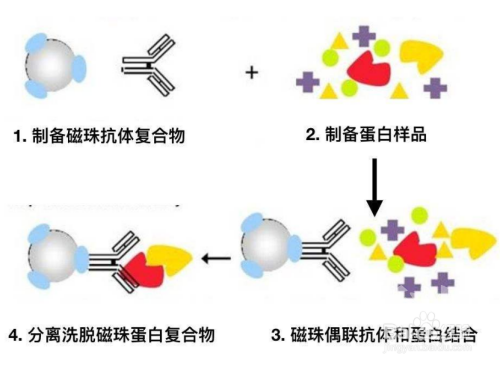
实验流程示意图(图片来源于网络)
原生质体转化请参考:
【原生质体】拟南芥原生质体的制备及转化
溶液配制:
蛋白提取液:0.05 M HEPES-KOH(pH 7.5),0.15 M KCl,1 mM EDTA,0.2% Triton-X 100,1 mM DTT,Protease Inhibitor Cocktail。
蛋白洗脱缓冲液:0.05 mol/L HEPES-KOH(pH 7.5),0.15 mol/L KCl,0.001 mol/L EDTA,0.2 % Triton-X 100,0.001 mol/L DTT。
注:DTT和Cocktail均现用现加。
实验步骤:
以HA和FLAG标签为例。
1. 提取转化有HA和FLAG质粒的原生质体总蛋白,取适量样品作为Input,用于鉴定目的蛋白表达量。
2. 取-20 ℃保存的anti-flag M2 agarose(Sigma),用蛋白洗脱缓冲液洗4次,4℃,4000 g,1 min。
3. 将60 µL处理好的anti-flag M2 agarose beads加入至冰上放置的原生质体总蛋白中,4 ℃孵育4 h。
4. 4 ℃,4000 g,3 min后弃上清,洗脱缓冲液洗6次beads,每次4000 g,1 min,去除非特异结合的蛋白。
5. 吸尽上清,加入适量终浓度为 0.5 mg/mL 3xFLAG多肽(sigma),4 ℃孵育1 h,竞争洗脱FLAG蛋白及互作蛋白。
6. 4 ℃,4000 g,1 min,吸取上清,重复离心2-3 次,确保样品中没有anti-flag M2 agarose残留。所得样品可用HA抗体进行互作检测。
7. 如果用HA抗体做免疫沉淀去拉FALG蛋白,可以在蛋白提取完后加入20 µL用洗脱缓冲液处理的 protein A agarose (Millipore),4 ℃孵育1 h,去除非特异性结合protein A的蛋白。
8. 4 ℃,4000 g,3 min后将上清转移入新的离心管中,加入2 µg HA抗体孵育2 h,再加入protein A agarose 继续孵育2 h。
9. 洗脱缓冲液洗6次,吸取上清,最后加入蛋白上样缓冲液至终浓度为1x,100 ℃加热变性5 min,用FLAG抗体检测互作蛋白。
来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247494939&idx=2&sn=8289e00c70b947396e106d605c824d4c
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
乙肝e抗体
抗线粒体抗体
前S抗体
埃博拉幸存者的抗体带来疫苗研发新途径 |《自然-结构和分子生物学》
功能性抗体怎么玩,不知道你就 out 了
缓冲液检查

“双剑合璧”,艾滋病功能性治愈未来可期

2018年诺贝尔生理学或医学奖公布:肿瘤免疫治疗获得肯定

《自然综述:风湿病学》中文版2018年第2期----肌炎专刊
前S抗体