科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-20
来源:BioArt
原标题:Cell Reports:高绍荣/高亚威团队首次发现NEXT复合物关键因子Zcchc8对LINE1 RNA的降解作用
RNA外切体(exosome)是细胞中控制RNA降解及维持RNA总量稳定的重要复合物,被称为细胞监视器。其主要作用是负责细胞核内的RNA降解,以实现低质量RNA以及不稳定RNA的清除以及应激反应等【1】。在哺乳动物细胞中,NEXT复合物(Nuclear exosome targeting complex)被认为是RNA外切体的激活子之一,主要针对细胞核内新转录出来的RNA,招募RNA外切体对其进行降解【2】。NEXT complex的组分包括RNA识别蛋白RBM7,连接蛋白ZCCHC8以及招募外切体蛋白hMTR4。在Hela细胞系中研究人员发现NEXT复合物偏好识别一些短的非编码RNA如启动子上游反向RNA(PROMPTs)、内含子RNA(intron RNAs)和增强子区域的转录本(enhancer RNAs)等【3,4】。而NEXT复合物作为哺乳动物细胞中保守存在的重要的RNA外切体激活子,其在小鼠胚胎发育过程中的作用和调控机制尚未可知。
2019年11月19日,同济大学高绍荣团队在Cell Reports发表题为“Nuclear exosome targeting complex core factorZcchc8 regulates the degradation of LINE1 RNA in early embryos and embryonicstem cells”的研究论文,揭示了NEXT复合物关键因子Zcchc8在LINE1 RNA降解中发挥重要作用,从而对于小鼠卵母细胞成熟、早期胚胎发育以及胚胎干细胞的功能都非常重要。

研究人员首先发现Zcchc8基因敲除的小鼠仅有少数可以出生并存活,且存在发育迟缓、生殖障碍及生存率低等表型,进一步研究发现,早在胚胎时期,胎儿的发育就已发生迟缓。通过建立Zcchc8敲除的ES细胞系,发现其增殖能力降低和多能性基因表达降低,体外嵌合体实验也证实了其分化潜能下降。说明Zcchc8对小鼠的发育、胚胎干细胞的多能性维持和分化潜能都具有重要作用。紧接着,研究人员对Zcchc8以及NEXT复合物中另一成员RNA结合蛋白Rbm7在胚胎干细胞中进行了核内RNA免疫共沉淀(RIP)实验,发现除了之前在肿瘤细胞系中发现的底物RNA如PROMPTs,enhancer RNAs等之外,很多逆转座子RNA如LINE1,LTR中的MusD/ETn, MERVL等,也是NEXT复合物的底物。接下来,RNA半衰期的检测实验证明LINE1的半衰期受到更大的影响,说明NEXT复合物确实对LINE1 RNA的降解具有重要作用。经验证,LINE1确实在Zcchc8敲除的胚胎干细胞中异常升高,在敲降或敲除的早期胚胎和GV(germinal vesicle)卵中具有更高的RNA水平,说明Zcchc8在小鼠早期胚胎发育以及卵成熟过程中都具有对LINE1的转录后调控作用。由于LINE1的激活被认为对小鼠的基因组稳定性,染色体可及性以及卵发育都有重要作用【5,6】,研究人员利用DNaseI酶切后染色实验(TUNEL)发现在Zcchc8敲除的卵以及敲降的胚胎4-细胞中,染色质具有更高的可及性。
作为基因组中占比最高的逆转座子重复序列LINE 1(小鼠中占约19%),其RNA水平不仅影响了LINE1的蛋白水平和转座活性,也和染色质具有密切的关系【7】。而目前对其RNA水平的调控方式的研究十分欠缺。本研究首次提出了NEXT复合物对LINE1 RNA水平的调控具有重要作用,且在发育过程中具有重要意义。此研究为核内RNA的调控方式提供了更多思路,展示了该方向的最新进展。
同济大学高绍荣教授课题组的直博生吴悠为本文的第一作者;同济大学高绍荣教授,高亚威教授为本文的共同通讯作者。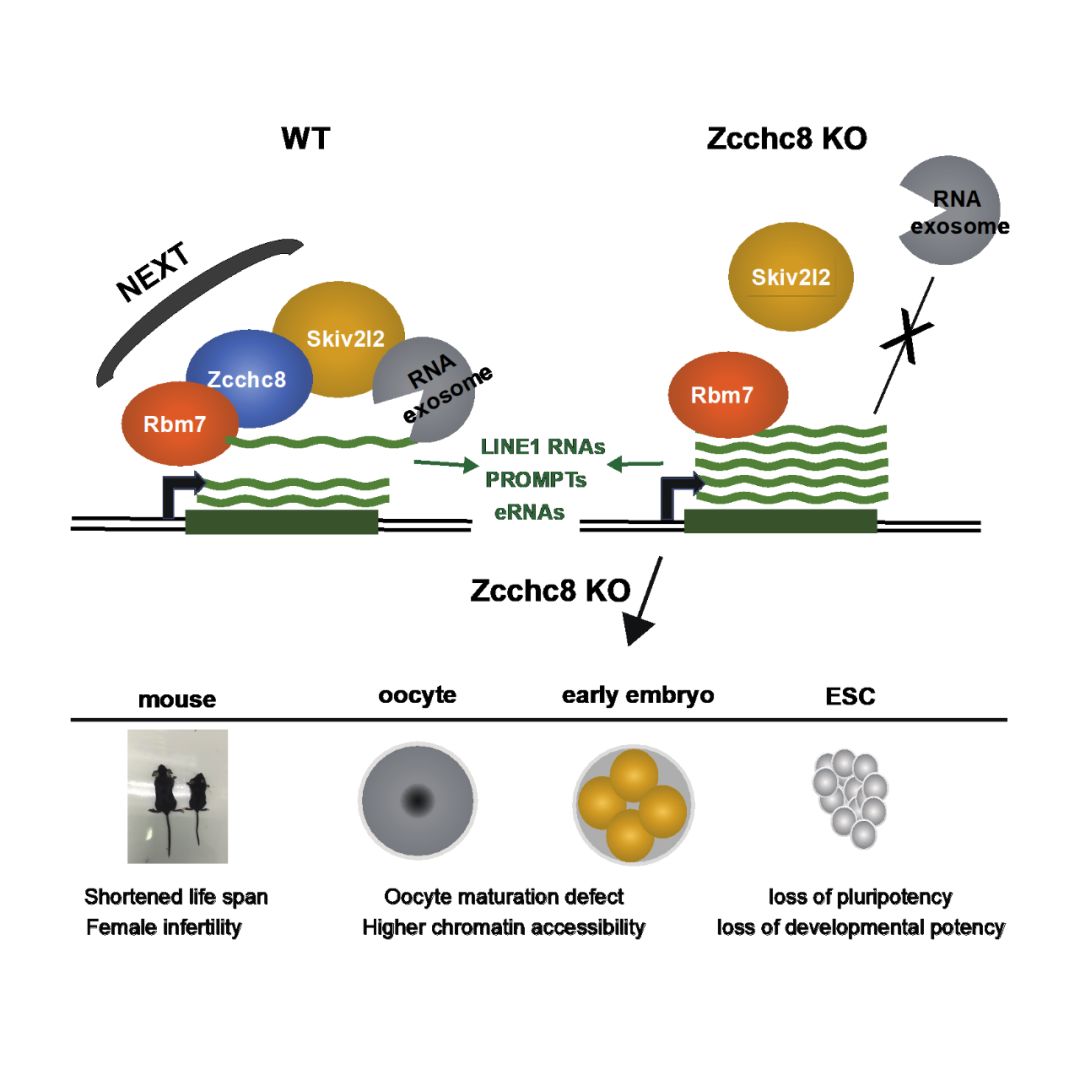
原文链接:
https://doi.org/10.1016/j.celrep.2019.10.055
参考文献
1. Kilchert, C.,Wittmann, S., and Vasiljeva, L. (2016). The regulation and functions of thenuclear RNA exosome complex. Nature reviews Molecular cell biology 17, 227-239.
2. Lubas, M.,Christensen, M.S., Kristiansen, M.S., Domanski, M., Falkenby, L.G.,Lykke-Andersen, S., Andersen, J.S., Dziembowski, A., and Jensen, T.H. (2011).Interaction profiling identifies the human nuclear exosome targeting complex.Molecular cell 43, 624-637.
3. Hrossova,D., Sikorsky, T., Potesil, D., Bartosovic, M., Pasulka, J., Zdrahal, Z., Stefl,R., and Vanacova, S. (2015). RBM7 subunit of the NEXT complex binds U-richsequences and targets 3'-end extended forms of snRNAs. Nucleic acids research 43, 4236-4248.
4. Lubas, M.,Andersen, P.R., Schein, A., Dziembowski, A., Kudla, G., and Jensen, T.H.(2015). The human nuclear exosome targeting complex is loaded onto newlysynthesized RNA to direct early ribonucleolysis. Cell reports 10, 178-192.
5. Jachowicz,J.W., Bing, X., Pontabry, J., Boskovic, A., Rando, O.J., and Torres-Padilla,M.E. (2017). LINE-1 activation after fertilization regulates global chromatinaccessibility in the early mouse embryo. Nature genetics 49, 1502-1510.
6. Malki, S., vander Heijden, G.W., O'Donnell, K.A., Martin, S.L., and Bortvin, A. (2014). Arole for retrotransposon LINE-1 in fetal oocyte attrition in mice.Developmental cell 29, 521-533.
7. Percharde, M.,Lin, C.J., Yin, Y., Guan, J., Peixoto, G.A., Bulut-Karslioglu, A., Biechele,S., Huang, B., Shen, X., and Ramalho-Santos, M. (2018). A LINE1-NucleolinPartnership Regulates Early Development and ESC Identity. Cell 174, 391-405 e319.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478008&idx=5&sn=6d8f26e347bafd73009a41fbbd873cf4&chksm=84e2098cb395809afe5220404f2a149ae1b93234f795a767baa407f03476d6be973152000f94&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

鼠皮肤细胞转化为胚胎所需干细胞
《细胞》:首次在虚拟胚胎中进行单细胞研究
研究揭示人胚胎干细胞衍生心血管前体细胞胞外囊泡的心脏保护作用及机制
杨黄恬研究组揭示人胚胎干细胞衍生心血管前体细胞胞外囊泡的心脏保护作用及机制

学术造假必遭严惩,为何仍不断有人冒险

揭秘细胞外RNA
杨黄恬研究组揭示人胚胎干细胞衍生心血管前体细胞胞外囊泡的心脏保护作用及机制

活细胞RNA成像技术获突破

《细胞》:CRISPR编辑人类胚胎存在重大隐患
失去细胞核的细胞在3D环境中举步维艰