科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-21
来源:BioArt
撰文 | 敏君
细菌通过获取噬菌体的短链DNA序列或其它外源DNA,并将其组装至基因组的CRISPR位点,以此来获得免疫记忆【1】。半数细菌都携带有这种CRISPR-Cas适应性免疫系统,而CRISPR位点在自然环境中的进化也非常迅速【2,3】。在实验室条件下,细菌通常以突变或表面受体丢失这两种方式进化出对噬菌体的抵抗性【4】。在“超级细菌”横行的今天,作为抗生素的替代性治疗手段,噬菌体疗法正面临着这两大挑战。因此,揭示环境因素是如何影响细菌进化出噬菌体抗性的,是目前亟待解决的科学问题。
已有研究表明,在营养富足型培养基中,尽管携带有效的CRISPR-Cas适应性免疫系统,绿脓假单胞菌PA14菌株仍然主要依赖于噬菌体受体的修饰或完全丢失,以对抗其噬菌体DMSvir的感染。相反,在营养限制条件下,PA14则依赖于CRISPR-Cas获得对噬菌体的抗性。由此可见,营养条件这一环境因素改变了噬菌体的密度,从而决定了自然选择是倾向于选择表面受体突变方式还是CRISPR突变方式,使细菌获得抗性【5】。尽管这些研究表明了非生物因素是细菌对噬菌体抗性策略进化的关键因素,然而在自然环境和临床条件下,绿脓假单胞菌通常与其他种类的细菌共存【6】,而目前同一生境中其他生物是如何影响噬菌体抗性进化的仍知之甚少。
2019年10月24日,来自英国埃克塞特大学环境与可持续发展研究所的Edze R.Westra教授团队,在Nature杂志上发表题为Bacterial biodiversity drives the evolution of CRISPR-based phageresistance的文章。该研究以条件致病菌绿脓假单胞菌(Pseudomonas aeruginosa)PA14菌株及其噬菌体DMSvir为研究对象,揭示了自然环境中微生物群落的复杂性是CRISPR-Cas适应性免疫进化的重要驱动因素,其对于细菌的适应性和毒力也至关重要。

为探究多种群共存条件下绿脓假单胞菌对噬菌体抵抗性的进化,作者提出假设,认为细菌群落能够驱动绿脓假单胞菌基于CRISPR的噬菌体抗性进化。这一假设的提出基于以下两点:一是在竞争者存在的条件下,绿脓假单胞菌的密度降低,从而限制了噬菌体的增殖,因此基于CRISPR的噬菌体抗性进化占优势;二是在种间竞争存在的条件下,噬菌体受体突变的方式会增加细菌的多效性成本(Pleiotropic cost)。
为了验证这个假设,作者将3种不能被噬菌体DMSvir感染的条件致病菌,包括金黄色葡萄球菌(Staphylococcus aureus)、伯克霍尔德氏菌(Burkholderia cenocepacia)和鲍氏不动杆菌(Acinetobacter baumannii),与PA14突变体共培养,以诱导种间竞争。其中PA14突变体携带链霉素抗性,用以监控菌群密度。结果表明,种间竞争强度与CRISPR进化呈正相关,且高强度的种间竞争促进了细菌基于CRISPR的噬菌体抗性的进化。
作者进一步探究了基于CRISPR的抗性进化是如何在菌落竞争中发生的。结果发现噬菌体感染力的变化和初始感染浓度并不影响宿主菌CRISPR相关抗性的进化。作者推测由于细菌表面分子在种间竞争中发挥重要功能,基于表面受体的抗性进化成本较高,因此在种间竞争环境下,细菌倾向于选择另外一种更加经济的抗性进化方式——基于CRISPR的抗性进化。随后,作者通过环境中菌落种类的增加与抗性进化方式的选择之间的相关性,证实了这一假说。
当表面结构改变时,病原菌对噬菌体的抗性进化往往与毒性权衡有关,因此作者推测,细菌对噬菌体抗性演变的环境因素与其毒性具有重要的连锁效应。作者证明,与基于CRISPR的抗性进化相比,基于表面受体的抗性进化会显著减弱致病菌的毒力。这也从另一方面解释了在多菌群环境中,细菌为何倾向于选择基于CRISPR的抗性进化方式。
综上,该研究发现了环境中微生物群落能通过种间竞争等方式改变细菌与噬菌体的进化关系,并且能够改变宿主菌在抵抗噬菌体感染下的进化策略。阐明CRISPR进化的驱动因素和所产生的效果,能大大增强我们在复杂的自然环境中控制细菌-噬菌体互作的能力,并能帮助我们在临床环境中优化噬菌体疗法的可靠性。
原文链接
https://doi.org/10.1038/s41586-019-1662-9
参考文献
1. Barrangou, R. et al. CRISPR provides acquired resistance against viruses inprokaryotes. Science 315, 1709–1712 (2007)
2. Grissa, I., Vergnaud, G. & Pourcel, C. CRISPRcompar: a website tocompare clustered regularly interspaced short palindromic repeats. NucleicAcids Res. 36, W145–W148 (2008).
3. Laanto, E., Hoikkala, V., Ravantti, J. & Sundberg, L. R. Long-termgenomic coevolution of host–parasite interaction in the natural environment.Nat. Commun. 8, 111 (2017).
4. Van Houte, S., Buckling, A. & Westra, E. R. Evolutionary ecology ofprokaryotic immune mechanisms. Microbiol. Mol. Biol. Rev. 80, 745–763 (2016).
5. Westra, E. R. et al. Parasite exposure drives selective evolution ofconstitutive versus inducible defense. Curr. Biol. 25, 1043–1049 (2015).
6. O’Brien, S. & Fothergill, J. L. The role of multispecies socialinteractions in shaping Pseudomonas aeruginosa pathogenicity in the cysticfibrosis lung. FEMS Microbiol. Lett. 364, 1–10 (2017).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478027&idx=6&sn=4d8f739d39fab9c662b6a018bdc81c4f&chksm=84e209ffb39580e9c835311117d89e2c78f018aa83390c0519d78b0f29289e2e21443b63e490&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Jennifer Doudna课题组在噬菌体中发现了新CRISPR扩展工具

Nature重磅:噬菌体疗法成功治疗酒精性肝病

中国科学家培育出基因编辑瘦肉猪:脂肪少24%

蒲慕明院士:建设世界一流期刊关系学术创新的发言权
噬菌体抑制细菌CRISPR-Cas系统机制领域取得重要进展
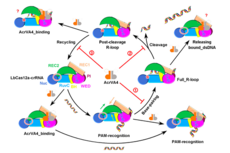
微生物所等在噬菌体抑制细菌CRISPR-Cas系统机制研究中获进展
人类肠道每天能吸收300亿噬菌体

大型恒星比想象的更多

Cell :噬菌体抗菌疗法开发

两项研究称CRISPR改造过的细胞或易癌变