科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-21
来源:BioArt
撰文 | 十一月
次级主动运输利用电化学离子梯度的能量驱动底物跨细胞膜转运,对于细胞中多种生理功能如营养吸收、离子稳态、抗菌物质外排、神经传递具有非常关键的作用【1-4】。但是对于次级主动运输的机制研究碍于其运输效率较低以及现有方法的局限性而很难继续推进。神经递质:钠共转运蛋白(Neurotransmitter: sodium symporters,NSS)通过清除神经递质来调节突触活动。尽管NSS生理功能非常重要并且作为疾病治疗靶点具有很高的研究价值【5】,但是其转运周期中的各个步骤以及被神经调节剂调节的方式,仍然了解的很不清楚。
2019年11月14日,威尔康奈尔医学院Scott C. Blanchard研究组与哥伦比亚大学Matthias Quick、Jonathan A. Javitch研究组在Nature发表长文Quantifying secondary transport at single molecule resolution,通过对MhsT结合单底物分子跨越脂质双分子层单次和多次的结构翻转变化进行了成像,计算了MhsT的活性,揭开了在单分子水平对次级主动运输的研究。

以往工作使用系统电生理学、放射性示踪剂以及荧光分析等方法对一些特定的次级主动运输过程包括NSS家族的运输机制进行了研究【6,7】。但这些方法中对转运速率等方面的测量必须使用复杂且可能具有破坏性的生化或生理操作来推断运输周期中特定步骤的速率。已有一些使用单分子方法来检测运输周期中关键构象状态相关的单个转运蛋白的动力学【8-10】。但到目前为止,还没有什么方法能够用在单分子水平直接检测溶液中次级主动运输的详细过程与机制。
为了在单分子水平对次级主动运输进行研究,作者们使用了单分子荧光共振能量转移技术(Single-molecule fluorescence resonance energy transfer,smFRET),对单个转运复合体的活性进行精确测量,并能够检测NSS运转周期中的单个步骤。单分子荧光共振能量转移技术不涉及对转运蛋白本身的修饰,而是使用封装的传感器蛋白报告被运输的底物分子进入蛋白脂质体的腔内的运动【11】。细菌周质结合蛋白通过使用类似蛤壳的封闭机制从细胞环境中清除底物来帮助支持细胞生长和增殖【11】。为了利用荧光共振能量转移技术检测配基的结合,作者们使用细菌周质结合蛋白相反的两个结构域建立了位点特异性模式的供体和受体荧光基团(图1)。在加入饱和浓度的配基之后,受体的荧光强度增加了40%。但是考虑囊泡内腔中转运底物的浓度较比饱和浓度要低,作者们对用于FRET的细胞周质蛋白进行了改造,使得其表现出与体内类似的FRET增长。在进行氨基酸感受的实验之后,作者们发现改造后的细菌周质蛋白感受器会表现出依赖于浓度的变化,并且不会出现双峰的数据,说明改造后的FRET系统更贴近体内的特性。
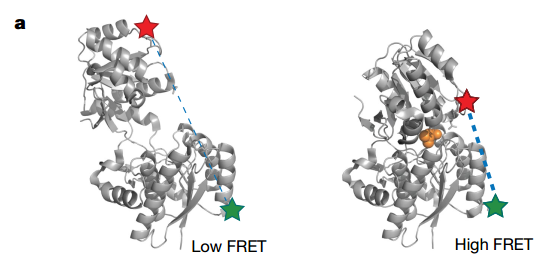
图1 疏水氨基酸感应器细菌周质蛋白LIV-BP FRET设计方案
为了对MhsT转运疏水氨基酸的进行测量,作者们使用biotin–(NTA-Ni2+) 桥系统【12】在脂蛋白体中模拟重建MhsT蛋白与改造后的FRET感受器。在单分子水平研究后发现,当且仅当转运蛋白在膜上处于生理方向时,MhsT才能有效催化底物运转。单周转量测量显示了运输的前半个周期的动力学,包括底物结合、转运蛋白异构化和底物释放。单周转速率和多周转速率的比较动力学分析描绘了第二个半周期的动力学,第二个半周期将底物释放到内腔中后,使转运蛋白返回朝外状态。这些测量结果表明,返回步骤的速率取决于在运输周期的前半部分中被转运的底物的身份。
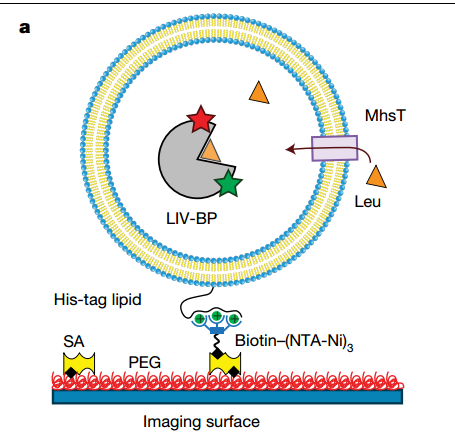
图2 biotin–(NTA-Ni2+) 桥系统12模拟重建MhsT蛋白与改造后的FRET感受器
Matthias Quick、Jonathan A. Javitch与Scott C. Blanchard研究组的工作第一次在单分子水平上揭开了次级转运蛋白周转疏水性氨基酸的过程以及发现了该次级转运蛋白仅在特定的方向时才能够正常发挥转运功能。而且,此工作中使用的单分子技术对于其他的初级主动运输和次级主动运输提供了新的工具和可能性。
原文链接:
https://www.nature.com/articles/s41586-019-1747-5
参考文献
1. Forrest, L. R., Kramer, R. & Ziegler, C. The structural basis of secondary active transport mechanisms. Biochimica et biophysica acta 1807, 167-188, doi:10.1016/j.bbabio.2010.10.014 (2011).
2. Shi, Y. Common folds and transport mechanisms of secondary active transporters. Annual review of biophysics 42, 51-72, doi:10.1146/annurev-biophys-083012-130429 (2013).
3. Pao, S. S., Paulsen, I. T. & Saier, M. H., Jr. Major facilitator superfamily. Microbiology and molecular biology reviews : MMBR 62, 1-34 (1998).
4. Kristensen, A. S. et al. SLC6 neurotransmitter transporters: structure, function, and regulation. Pharmacological reviews 63, 585-640, doi:10.1124/pr.108.000869 (2011).
5. Sitte, H. H. et al. Carrier-mediated release, transport rates, and charge transfer induced by amphetamine, tyramine, and dopamine in mammalian cells transfected with the human dopamine transporter. Journal of neurochemistry 71, 1289-1297, doi:10.1046/j.1471-4159.1998.71031289.x (1998).
6. Accardi, A. & Miller, C. Secondary active transport mediated by a prokaryotic homologue of ClC Cl- channels. Nature 427, 803-807, doi:10.1038/nature02314 (2004).
7. Gorraitz, E., Hirayama, B. A., Paz, A., Wright, E. M. & Loo, D. D. F. Active site voltage clamp fluorometry of the sodium glucose cotransporter hSGLT1. Proceedings of the National Academy of Sciences of the United States of America 114, E9980-E9988, doi:10.1073/pnas.1713899114 (2017).
8. Majumdar, D. S. et al. Single-molecule FRET reveals sugar-induced conformational dynamics in LacY. Proceedings of the National Academy of Sciences of the United States of America 104, 12640-12645, doi:10.1073/pnas.0700969104 (2007).
9. Akyuz, N., Altman, R. B., Blanchard, S. C. & Boudker, O. Transport dynamics in a glutamate transporter homologue. Nature 502, 114-118, doi:10.1038/nature12265 (2013).
10. Akyuz, N. et al. Transport domain unlocking sets the uptake rate of an aspartate transporter. Nature 518, 68-73, doi:10.1038/nature14158 (2015).
11. Okumoto, S. Quantitative imaging using genetically encoded sensors for small molecules in plants. The Plant journal : for cell and molecular biology 70, 108-117, doi:10.1111/j.1365-313X.2012.04910.x (2012).
12. Lata, S., Reichel, A., Brock, R., Tampe, R. & Piehler, J. High-affinity adaptors for switchable recognition of histidine-tagged proteins. Journal of the American Chemical Society 127, 10205-10215, doi:10.1021/ja050690c (2005).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478027&idx=5&sn=1c9b249337dae2a608cb3f9cb43d63ee&chksm=84e209ffb39580e9d3960391e63cabf7188a4ddc10ecedca878f72ca181d5a5700b273f0bb5b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
魏勇等-Nature Astronomy:中国的行星探索路线图
华侨大学博士生首次在Nature发文




大型恒星比想象的更多

首个具有主动运输能力的“人造细胞”问世,未来或将助力体内药物输送

光催化,今日《Nature》!

今年热怕了?Nature子刊:别急,未来4年可能更热
Nature论文称,替代新烟碱的杀虫剂仍会伤害蜂群
主动运输
武汉大学今日Nature;华大基因Nature
更好的期刊,更好的科学——中国科技峰会·世界科技期刊论坛专家观点荟萃


