科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-24
来源:BioArt
急性淋巴细胞白血病(ALL)是一种主要发生于儿童和青少年的血液癌。它是由淋巴系前体细胞的恶性转化引起。由染色体异位导致基因融合产生的嵌合转录因子通过干扰正常血细胞发育调控是ALL的主要诱因之一。由17号和19号染色体异位产生的TCF3-HLF嵌合转录因子会诱导产生一类罕见的高危ALL【1】。患者即使接受高剂量组合化疗和干细胞移植也伴随极高的复发率。
TCF3-HLF嵌合体由TCF3因子的转录激活域和HLF因子的DNA结合域组成。TCF3是驱动B淋巴细胞发育的转录因子,而HLF是参与维持造血干细胞库所必需的的因子。到目前为止尚无法在小鼠模型中模拟TCF3-HLF诱导ALL的发病过程,揭示了人源细胞环境对该种ALL发生的重要性。通过移植瘤(PDX)模型结合基因组和转录组测序,研究显示TCF3-HLF ALL伴随高频的 PAX5单等位基因缺陷,以及干细胞和髓系细胞的基因表达特征,表明TCF3-HLF影响细胞的命运决定【2】。由于嵌合转录因子导致的基因表达失调是诱导许多癌症的关键驱动因素,同时这些癌症伴随对特定转录程序的依赖性【3】,因此,深入探索内源TCF3-HLF的调控组和相互作用组,并在功能上筛选维持疾病症状的决定因子将为靶向治疗该高危ALL提供重要线索。
2019年11月14日,瑞士苏黎世大学儿童医院的Jean-Pierre Bourquin教授团队在Cancer Cell杂志上在线发表题为The Leukemogenic TCF3-HLF Complex RewiresEnhancers Driving Cellular Identity and Self-Renewal Conferring EP300Vulnerability 的研究文章(本文第一作者为黄韵博士,苏黎世大学儿童医院的Brice Mouttet博士和德国马克斯-普朗克研究所Hans-Jörg Warnatz博士为共同一作)。该文揭示了TCF3-HLF 嵌合转录因子通过劫持造血干细胞相关转录因子HLF在DNA上的结合位点, 激活干细胞相关的增强子(enhancer)活性,诱导B细胞恶性转化的分子机制。

研究人员首先通过CRISPR/Cas9 技术敲除ALL 细胞中的TCF3-HLF基因,并观察到TCF3-HLF缺失抑制了ALL细胞在免疫缺陷鼠中致瘤,揭示TCF3-HLF不仅是ALL的诱因也是维持ALL不可或缺的。转录组测序(RNA-Seq)显示TCF3-HLF敲除导致干细胞和髓系相关的基因表达下调而淋巴系尤其是伴随祖B细胞(pro-B)转化为前B细胞 (pre-B)的基因表达上调,揭示TCF3-HLF 阻断淋巴系的发育进程。RNA-Seq同时显示TCF3-HLF通过两套通路诱导源癌基因MYC的表达:直接转录水平激活MYC和抑制参与MYC泛素化降解途径的重要基因FBXW7的表达以稳定MYC蛋白。基因集富集分析(GSEA)显示, 由MYC调控的代谢稳态相关基因(包括参与核糖体生成,mRNA翻译,线粒体和氧化磷酸化的基因)构成最重要的依赖TCF3-HLF的细胞代谢途径。因此,TCF3-HLF 一方面激活MYC驱动的程序以维持代谢稳态,同时阻断B淋巴细胞的发育进程。
研究人员进一步通过染色质免疫沉淀-测序(ChIP-Seq)检测到484个TCF3-HLF在DNA上的结合位点。这些结合位点区域的染色质呈现增强子相关的组蛋白修饰,并且邻近这些位点富集了白血病相关的致病基因。特别的,在MYC基因位点下游大约1.9 Mb处,研究人员检查到两个超级增强子(super-enhancer)。其中之一结合了TCF3-HLF。基因组空间邻近分析(Hi-C)显示这一结合TCF3-HLF的超级增强子和MYC基因座分别处于一个保守的拓扑结构域 (topologically associating domains, TAD) 的两边界,揭示这两个位点在三维空间上是邻近的【4】。
作者进一步通过染色体构象捕获(chromosome conformationcapture, 3C)证实TCF3-HLF 参与稳定该增强子与MYC启动子之间的联系。最后,在移植瘤模型中通过CRISPR/Cas9对TCF3-HLF 在该增强子中的结合位点DNA序列(motif)的编辑,作者在功能上证实这一非编码区直接参与MYC的表达调控和维持TCF3-HLF ALL细胞的存活。同时,在对不同谱系血液细胞的ChIP-Seq数据分析时,作者发现这一被TCF3-HLF调节的超级增强子同时也在造血干细胞以及急性髓系白血病(AML)细胞中高度活化【5】。该区域高度保守,且近期的研究显示其在小鼠中的直系同源区域对调控Myc基因表达及造血干细胞和祖细胞的发育极为重要,被称为“血液增强子簇(BENC)”【6】。而在造血干细胞和祖细胞中这一区域结合了干细胞相关转录因子HLF【7】。
这些证据显示TCF3-HLF嵌合转录因子通过劫持造血干细胞转录因子HLF在DNA上的结合位点, 以激活干细胞相关的增强子活性从而干扰B细胞正常发育进程并诱导细胞转化。
虽然TCF3-HLF以及MYC对于维持ALL至关重要,但针对转录因子很难设计小分子抑制剂。为了系统的描绘TCF3-HLF复合体功能相关的蛋白以寻找可以抑制TCF3-HLF活性的其他途径,作者通过TCF3-HLF DNA motif分析以及免疫共沉淀-质谱(IP-MS)检测到90个TCF3-HLF结合蛋白。
进一步,通过CRISPR screen系统地对TCF3-HLF的结合蛋白,调控基因以及结合位点进行功能缺失筛查以探索可行的抑制TCF3-HLF ALL的途径。CRISPR筛选显示ETS家族转录因子ERG和组蛋白乙酰转移酶p300(EP300)对维持TCF3-HLF ALL细胞生存极为重要。TCF3-HLF通过招募ERG和EP300以激活增强子并驱动基因表达。
最后,基于这些功能基因组/蛋白组信息,作者探索了一种新型的EP300抑制剂,A-485,对TCF3-HLF ALL细胞转录组以及小鼠体内致瘤性的影响【8】。
研究发现A-485可以有效抑制TCF3-HLF驱动的增强子活性,特异的抑制TCF3-HLF驱动的基因表达并有效的抑制TCF3-HLF ALL细胞在免疫缺陷鼠中的生长,揭示EP300是一个潜在的治疗靶点。
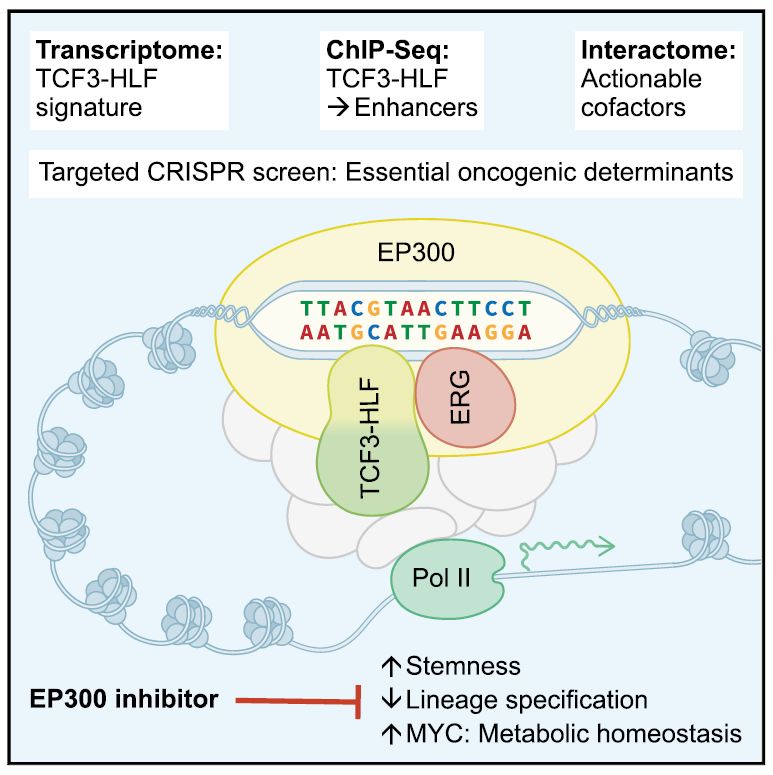
综上,该研究通过一系列实验在分子水平上揭示了TCF3-HLF的表观遗传活性,并通过功能基因组/蛋白组研究探索了抑制TCF3-HLF活性的潜在治疗方案。由于其他类型白血病也可能具有相似的机制,该研究开拓了对嵌合转录因子致癌作用机制的进一步了解。
原文链接:
https://doi.org/10.1016/j.ccell.2019.10.004
参考文献
1. Inaba T, Roberts WM, Shapiro LH, et al.Fusion of the leucine zipper gene HLF to the E2A gene in human acute B-lineageleukemia. Science.1992;257(5069):531-534.
2. FischerU, Forster M, Rinaldi A, et al. Genomics and drug profiling of fatalTCF3-HLF-positive acute lymphoblastic leukemia identifies recurrent mutationpatterns and therapeutic options. NatGenet. 2015;47(9):1020-1029.
3. BradnerJE, Hnisz D, Young RA. Transcriptional Addiction in Cancer. Cell. 2017;168(4):629-643.
4. RaoSS, Huntley MH, Durand NC, et al. A 3D map of the human genome at kilobaseresolution reveals principles of chromatin looping. Cell. 2014;159(7):1665-1680.
5. ShiJ, Whyte WA, Zepeda-Mendoza CJ, et al. Role of SWI/SNF in acute leukemiamaintenance and enhancer-mediated Myc regulation. Genes Dev.2013;27(24):2648-2662.
6. Bahr C, von Paleske L, Uslu VV, et al. A Myc enhancer cluster regulates normal and leukaemic haematopoieticstem cell hierarchies. Nature.2018;553(7689):515-520.
7. WahlestedtM, Ladopoulos V, Hidalgo I, et al. Critical Modulation of Hematopoietic LineageFate by Hepatic Leukemia Factor. Cell Rep.2017;21(8):2251-2263.
8. Lasko LM, Jakob CG, Edalji RP, et al.Discovery of a selective catalytic p300/CBP inhibitor that targetslineage-specific tumours. Nature.2017;550(7674):128-132.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652478126&idx=6&sn=c1266f41431fc14d7f468567c60bc06b&chksm=84e2091ab395800c21d1a5246449d76c1c58122f84f61908df282c18dd75d1fdc5bae4ddf782&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

科学家首次揭秘新生造血干细胞在体归巢全过程

科学家解析NK细胞白血病功能基因组,已启动临床试验

为什么总有孩子得白血病?
吃辣条会导致白血病?
多毛细胞白血病
靶向白血病微环境治疗白血病研究取得进展
吃粉条会导致白血病?

【科普】如何预防白血病的发生
靶向基因变异精准“击退”白血病
广州生物院在靶向白血病微环境治疗白血病领域取得进展