科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-12-19
来源:BioArt
撰文 | 章台柳
责编 | 兮
微管是由α/ β微管蛋白异二聚体组成的动态毫米级多聚物,不仅能够形成定义细胞形态的结构支架,而且具有为运送货物的运动蛋白提供轨道、在分裂细胞中提供分离染色体所需的推力和拉力等多种重要的细胞功能【1】。目前对于微管生长和收缩的控制已经有了深入的研究,但是细胞中新生微管如何产生尚不清楚。
γ微管蛋白环状复合物(γ-TuRC)是组装成有核微管的巨分子,对真核生物中恰当的微管网络形成至关重要。微管蛋白样GTPase γ-微管蛋白定位在中心体,与至少五种蛋白质结合形成“环状”复合物【2】。细胞质中γ-TuRC不仅仅被招募到微管聚的经典位置,如中心体,而且被招募到非中心体位置,如减数分裂的纺锤体、高尔基前哨【3】、细胞质的其他区域。虽然γ-TuRC的发现和研究已经进行了30年,但γ-TuRC的组成以及其如何促进微管成核还有待进一步研究。
2019年12月17日,来自美国洛克菲勒大学的Tarun M. Kapoor在Cell杂志上发表文章Asymmetric Molecular Architecture of the Humanγ-Tubulin Ring Complex,解析了人源γ-TuRC的冷冻电镜结构,整体上为不对称的锥形结构,分辨率达到3.8Å。结构分析显示,GCP4、GCP5、GCP6能够形成不同的Y形组装体,结构上与γ-TuRC“接缝”远端的GCP2/GCP3亚单位相似。同时鉴定出一个包含肌动蛋白样蛋白的结构桥,并且横跨γ-TuRC的管腔。虽然γ-TuRC具有不对称性结构,但其能够将γ-tubulins安排成一个螺旋几何形状,以备有核微管的组装。γ-TuRC的亚单位具有多样性,这就提供了一个非常大的表面,以便于与不同调节性因子相互作用。

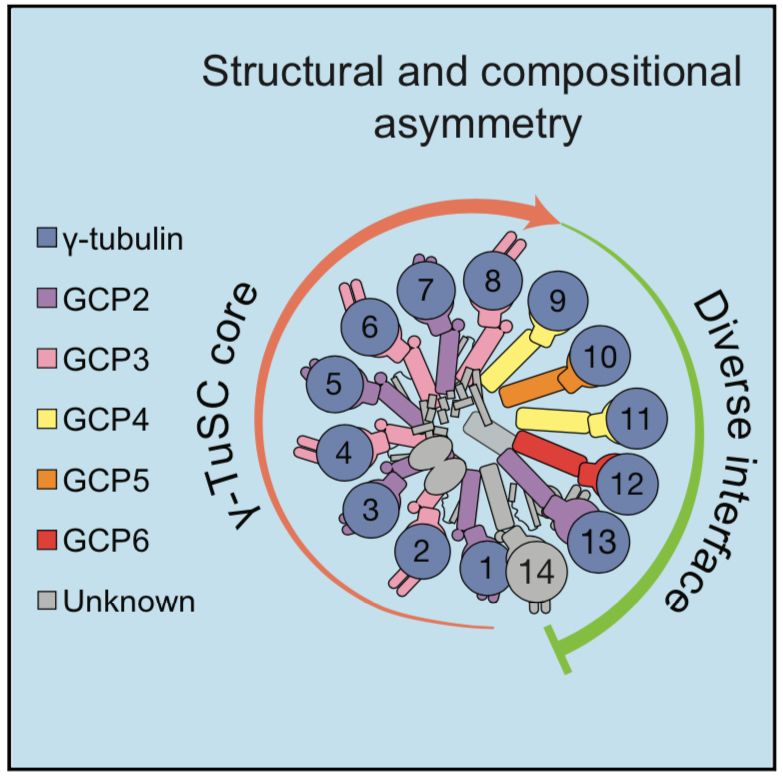
研究人员首先从HeLa S3细胞中分离天然性γ-TuRC,并进行冷冻电镜结构解析。γ-TuRC呈不对称性圆锥形状,直径为30nm,高度为20nm,整体分辨率约为3.8Å。14个大小相似(4nm宽)的球状结构由各自的茎状结构支撑,排列在圆锥体的开放面上;球状结构之间和茎状结构之间形成大量的横向连接,同时在复合体的锥体壁上留下一些狭窄的间隙。“塞子”结构向下延伸阻碍了γ-TuRC底部的开口。即人γ-TuRC锥状体由14个独立的亚单位组成,这些亚单位可以形成7个γ-TuSC亚复合物结构。复合物的不对称性体现在以下3点:将γ-TuRC的茎状结构分别编号1-14,2、4、6、8位置上有4个类似γ-TuSC亚复合物结构且具有“向外突出的密度”;9-14位置处有3个类似γ-TuSC亚复合物结构但缺少“向外突出的密度”,赋予γ-TuRC锥形体的椭圆度,即“螺旋偏差”;在锥形体结构的内腔中有一结构,“内腔桥梁”,与位置2-10的茎状结构相作用。而且,γ-TuRC复合物具有侧链。进一步分析显示,γ-微管蛋白侧链和鸟苷酸位于球状结构,即锥形体开放面上14个γ-微管蛋白。同时γ-微管蛋白:γ-微管蛋白侧面具有相互作用,一个γ-微管蛋白的H2’’、H3螺旋和另一个γ-微管蛋白的H6、H9螺旋间相互作用。
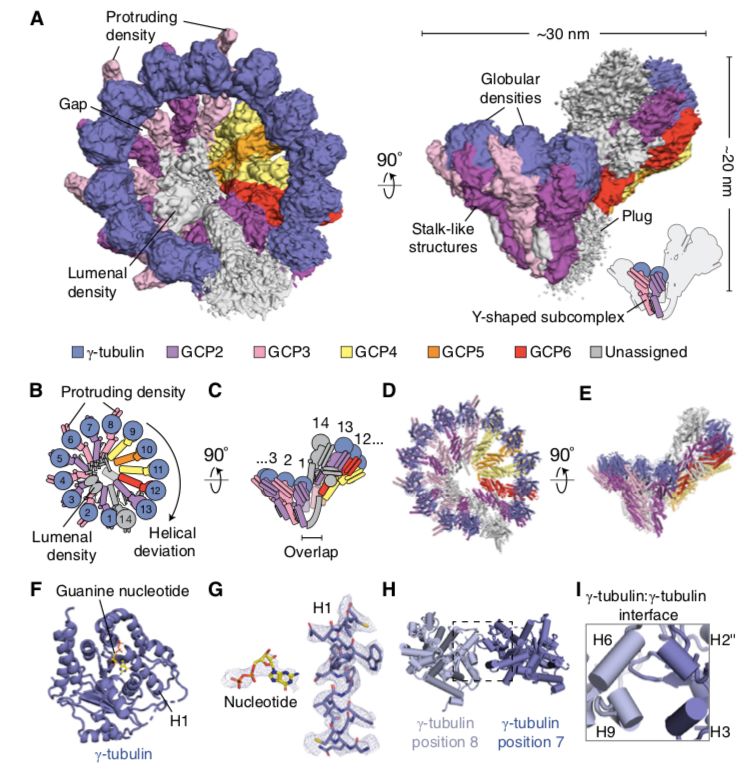
其次,研究人员对锥形体结构下部的茎状结构进行解析。这些茎状结构中每7个连续的具有一个特征性整体排列α螺旋构成一个束,共2个束。位置靠下的束(N端)采用延长的折叠方式,而位置较上的束(C端)与γ-微管蛋白相连,结构更紧密,在锥体的外表面呈现出一个突出的双螺旋发夹结构。位置9、11的密度与GCP4的晶体模型正好吻合,而且GCP4 C端向前一位置的亚单位旋转10度,螺旋21向GCP4相连的γ-微管蛋白偏转90度,以更好地适配到γ-TuRC锥形体结构。位置10上是GCP5,其与位置9的GCP4、各自相关的γ-微管蛋白构成Y形γ-TuSC亚复合物结构,“γ-TuG4/5”。位置12上是GCP6,其与位置11上GCP4、各自相关的γ-微管蛋白构成不同的Y形γ-TuSC亚复合物结构,“γ-TuG4/6”。GCP2与位置1、3、5、、7的密度吻合度极高,而GCP3可与位置2、4、6、8相匹配。每一对GCP2、GCP3的N端结构域之间有一个小的α螺旋,类似于一个“短纤维”,其与两种蛋白形成多个接触。而且GPC2、GCP3、各自的γ-微管蛋白构成Y形γ-TuSC,即位置1-8上具有4个Y形γ-TuSC亚复合物结构。位置13上与GCP2相匹配,位置14是GCP3,两者N端形成小α螺旋连接,形成Y形γ-TuSC亚复合物结构。γ-TuRC的位置1、2和位置13、14组成两个γ-TuSC,两者发生构像上改变,以构成略有重叠的区域。
最后,研究人员对“内腔桥梁”进行结构上分析,发现其由两部分构成:1)位于位置2的GCP3和位置3的GCP2附近的双叶密度;2)16个α螺旋排列成扩展束结构,横跨内腔,与位置9、10相连。双叶密度约5*5*2nm,由α螺旋和β片层的二级结构组成,一端与位置2、3的γ-微管蛋白相连,而且其具有类似actin的折叠方式。第二部分是由连续的短α螺旋构成的几个束结构,一端的α螺旋与类actin蛋白相连,一端与位置9的GCP4、位置10的GCP5相连。
总的来说,文章解析了细胞微管成核机器的高分辨率冷冻电镜结构——γ-TuRC的不对称性锥形体结构,并说明了其组成的复杂性使其具有自我调节组装过程,以控制在不同环境下的微管形成,为我们理解细胞微管新生过程提供结构基础。
原文链接:
https://doi.org/10.1016/j.cell.2019.12.007
参考文献
1. Forth, S., and Kapoor, T.M. (2017). Themechanics of microtubule networks in cell division. J. Cell Biol. 216,1525–1531.
2. Knop, M., Pereira, G., Geissler, S.,Grein, K., and Schiebel, E. (1997a). The spindle pole body component Spc97pinteracts with the gamma-tubulin of Saccharomyces cerevisiae and functions inmicrotubule organization and spindle pole body duplication. EMBO J. 16,1550–1564.
3. Rivero, S., Cardenas, J., Bornens, M., andRios, R.M. (2009). Microtubule nucleation at the cis-side of the Golgiapparatus requires AKAP450 and GM130. EMBO J. 28, 1016–1028.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479099&idx=2&sn=a6acbcb6c1808aba9e26a386867cb71b&chksm=84e20dcfb39584d9deba34b2a54e7f855ef6fe6067ea19c562ea08721210e7c938130c895c20&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn