科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-07-06
导读
沈阳药科大学药学院王思玲教授研究团队在化疗-光动力疗法联合抗肿瘤作用方面研究取得最新进展,相关研究成果“A versatile gas-generator promoting drug release and oxygen replenishment for amplifying photodynamic-chemotherapy synergetic anti-tumor effects”发表于国际纳米材料领域权威期刊Biomaterials(2021, 276: 120985, IF:12.479)。
肿瘤部位化疗药物和氧气的浓度对化疗-光动力联合抗肿瘤疗效至关重要。如何巧妙地设计一个简单的既能定位促进药物释放又能缓解肿瘤缺氧微环境的药物递送系统仍然是药剂学研究领域面临的挑战。现有的改善肿瘤缺氧微环境的手段存在以下不足:(1)生成O2的方式依赖于肿瘤组织的内源性物质;(2)补氧速率较慢,无法为快速生成大量的活性氧(ROS)提供条件。
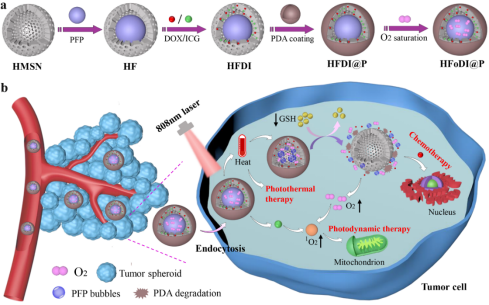
图1HFoDI@P的构建过程及其发挥化疗-光动力疗法
联合抗肿瘤作用的示意图
借鉴以上研究瓶颈,王思玲教授研究团队利用中空介孔二氧化硅纳米颗粒(HMSN)独特的空腔和介孔孔道结构同时装载O2饱和的全氟戊烷(PFP)、吲哚菁绿(ICG)和化疗药阿霉素(DOX),并以具有光热转换特性的聚多巴胺(PDA)包覆载药纳米粒,创新性地构建了具有高载药量、补氧和促进药物释放等特性的递送系统(HFoDI@P)。在808 nm的光照射下,载药系统与肿瘤微环境温度升高,导致PFP发生液-气相转变,PFP气化与温度升高的双重作用触发DOX和O2的爆发性释放,从而增强化疗-光动力联合抗肿瘤效果(如图1)。

图2光照期间DOX的释放,气态PFP的释放以及温度随时间变化的规律
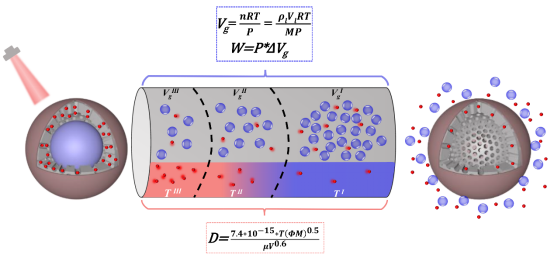
图3气态PFP和温度推动药物释放的机制
研究证实HFoDI@P在不依赖于肿瘤细胞内成分的前提下,可快速释放O2,为生成ROS提供充足的“燃料”。对光照射期间的药物释放,气态PFP的释放以及温度随时间变化的规律进行研究(如图2),并已阐明气态PFP和温度促进DOX释放的过程或机制(如图3)。
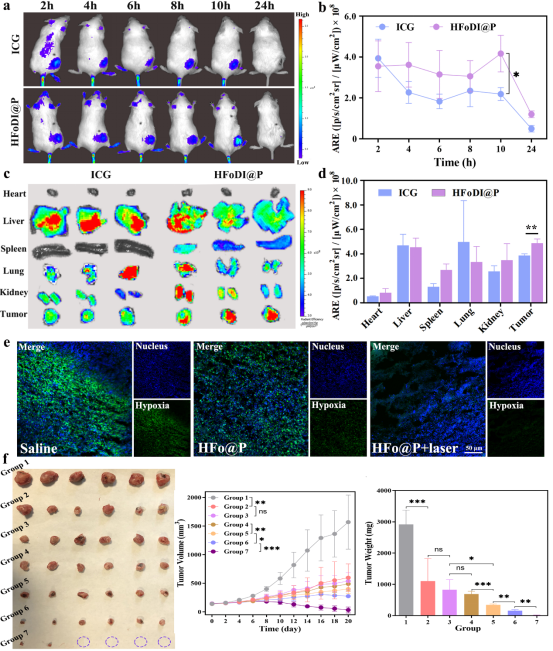
图4组织分布和化疗-光动力联合抗肿瘤效果
HFoDI@P在光照下借助ICG产生光敏作用的同时递药系统进行光热转换,显著增强了化疗-光动力联合抗肿瘤效果,抑瘤率可达99.7%(如图4)。此项工作,为阐明该递送系统的药物控制释放规律提供了新的研究思路及新的研究手段,对药物控制释放的研究具有指导与借鉴意义,为克服化疗-光动力联合抗肿瘤作用中存在的难题提供了创新性的探索途径。
来源:化学加
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwODA5MjQ3Ng==&mid=2653124977&idx=5&sn=ea0cc3e9c4cb2e858a60c2d82723309f
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Z型异质结调控肿瘤微环境增强肿瘤光动力疗法

【会议预告】|第三届肿瘤光动力治疗学术大会
疫情之下 肿瘤患者化疗怎么办?
化学所在天然生物小分子组装及其肿瘤光动力治疗方面取得进展

发光纳米颗粒可以更快更精准地检测癌症
中国抗癌协会肿瘤介入学专业委员会换届会议召开




【每日科技速递】国家发展改革委:大力推动营商环境改善
基于金立方包立方的智能诊疗纳米平台用于肿瘤多模态成像和光热、光动力和化疗联合治疗



《德国应化》:肿瘤胞吐小体/AIEgen杂化纳米囊泡,促进肿瘤渗透和光动力治疗
【纳米】聚合增强双光子光敏效应实现精准光动力肿瘤治疗