科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2021-07-10
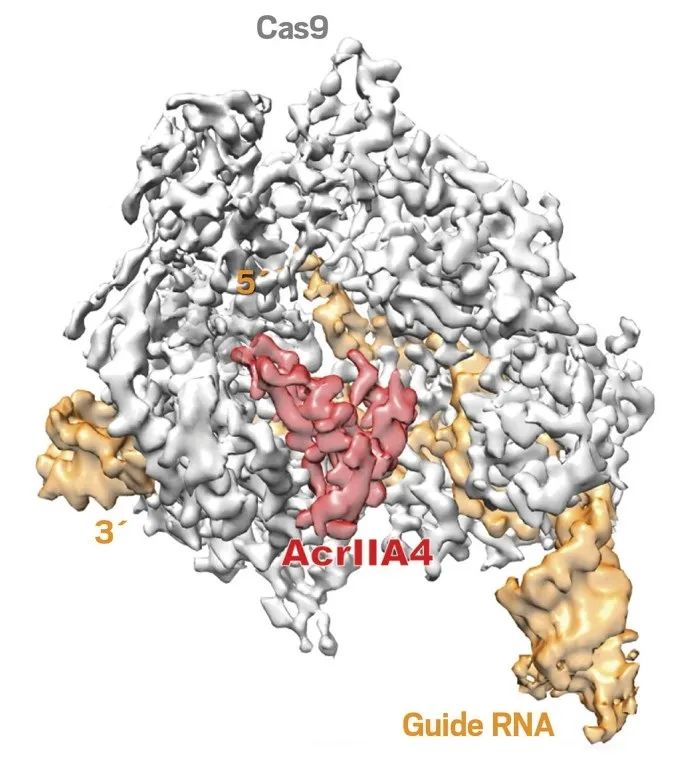
Credit: Adapted from Sci. Adv
冷冻电镜的重建显示抗CRISPR蛋白AcrIIA4与Cas9酶和向导RNA组成的化合物相结合。
抗CRISPR蛋白可帮助基因编辑“踩刹车"
科学家们正在探索该蛋白作为控制CRISPR及降低脱靶效应的可能性
CRISPR,作为2020年诺贝尔化学奖背后的技术,彻底改变了生命科学。该技术提供了基因组精准位置进行编辑的廉价、快速且简便的方法,并有可能改变遗传病和癌症治疗及其他应用的规则。但CRISPR面临着安全问题,因为科学家控制该技术的方法有限。
目前研究人员发现了一种被称为“抗CRISPR”的显著的多样的天然蛋白质,可为控制(CRISPR)提供训练的渠道。这些蛋白可在基因治疗后被传递以避免有害副作用,或助力将治疗引导至身体的正确部位。对于在群体中传播有益基因,抗CRISPR也可发挥作用—例如,控制昆虫。与此同时,与其他CRISPR控制方法相比,它具有几个优势,如可借助基因编码进入细胞。
CRISPR(成簇的、规律间隔的短回文重复序列,全称:clustered regularly interspaced short palindromic repeats)是细菌DNA的片段,是古老微生物防御系统的一部分。细菌使用来自CRISPR片段的RNA分子,随一些CRISPR关联基因 Cas(CRISPR associated,简称Cas)酶识别外源DNA并对其剪切。
2012年,科学家展示了一个在细胞基因组精准位点使用CRISPR RNA和Cas9酶剪切DNA的方法(Science, DOI: 10.1126/science.1225829)。基本上,全部所需仅为在细胞中导入Cas9酶和一个向导RNA——向导RNA可将酶引导至需剪切的位置。
不过CRISPR在细胞中保持活性越久,就越有可能编辑目标外的基因组部分,产生潜在的危险副作用。此外,CRISPR的许多潜在治疗应用需在特定组织中进行编辑;CRISPR在其他组织中的活动,无用是最好的,有害则是最糟的。
“想想我们人类所使用的任何技术——电视,电脑,微波炉……它们都有一个开关按钮,这是有原因的,”丹麦哥本哈根大学(University of Copenhagen)分子微生物学家Rafael Pinilla Redondo说,“你要有一个能够控制这些基因编辑技术的方法,否则后果可能是灾难性的。”
我们认为抗CRISPR对于CRISPR应用的发展和成功都非常重要。”日本京都大学(Kyoto University)的合成生物学家Hirohide Saito说,“抗CRISPR将应用于许多领域,而在需要安全的生物医药领域尤为有用。”
新兴应用
微生物学家Joseph Bondy-Denomy近十年前发现了抗CRISPR,当时他是加拿大多伦多大学(University of Toronto)的一名博士研究生。那时他在研究噬菌体,即感染细菌的病毒。在研究噬菌体之后,他研究将噬菌体的DNA编入细菌,使其宿主能够更好的抵御其他病毒,从而赢得竞争——上述的DNA插入,正是CRISPR常在细菌中阻止的。他意外的发现噬菌体产生的蛋白可抑制CRISPR-Cas系统。Bondy-Denomy现任职于美国加利福尼亚大学旧金山分校(the University of California, San Francisco),他与后来的同事将这些分子称之为抗CRISPR(anti-CRISPRs)。
至今,科学家们已发现50多个不同的anti-CRISPR家族。所有已知的抗CRISPR均为微量蛋白,通常为50-150个氨基酸大小。它们的序列和结构几乎并无相似之处,这表明它们均为独立进化而成。“抗CRISPR所发挥抑制机制的范围的广度真是十分显著,”美国马萨诸塞大学医学院( the University of Massachusetts Medical School)的分子生物学家Erik J. Sontheimer说。一些(抗CRISPR)抑制了Cas酶与DNA的结合能力,而另一些则阻止剪切DNA或干扰所依赖的向导RNA。
抗CRISPR最引人关注之处是对于旨在敲除问题基因的CRISPR疗法的调节。“关于CRISPR基因编辑的一个普遍担忧是其准确性,”Sontheimer指出。“Cas9可以靶向你想要的位点,但担忧是它最终也可能诱变你不希望的其他位点。”递送Cas9且在基因组预期位点编辑之后,科学家可以递送抗CRISPR以抑制酶和阻止非目标位置的编辑,他说。
例如,Bondy-Denomy及其同事体外使用CRISPR在人类白血病细胞中敲除基因时,他们发现当添加一种抗CRISPR 蛋白六小时之后,蛋白降低了CRISPR的脱靶效应 (Sci. Adv. 2017, DOI: 10.1126/sciadv.1701620)。作为共同创始人,Bondy-Denomy开设了名为“Acrigen Biosciences”的公司,专注于在治疗中应用抗CRISPR “当不再需要的时候,(借助抗CRISPR)使CRISPR失去活性,”他说。
抗CRISPR也可帮助将基因编辑限制于体内有需要的组织中。2019年,德国、日本和美国的三支独立团队修饰了抗CRISPR蛋白,使之接触到一些仅存于肝脏和心脏细胞等特定组织中的分子时,其活性被削减。“通过这种方式,我们可以决定需要编辑的细胞基因组,”日本团队带头人Saito说道。
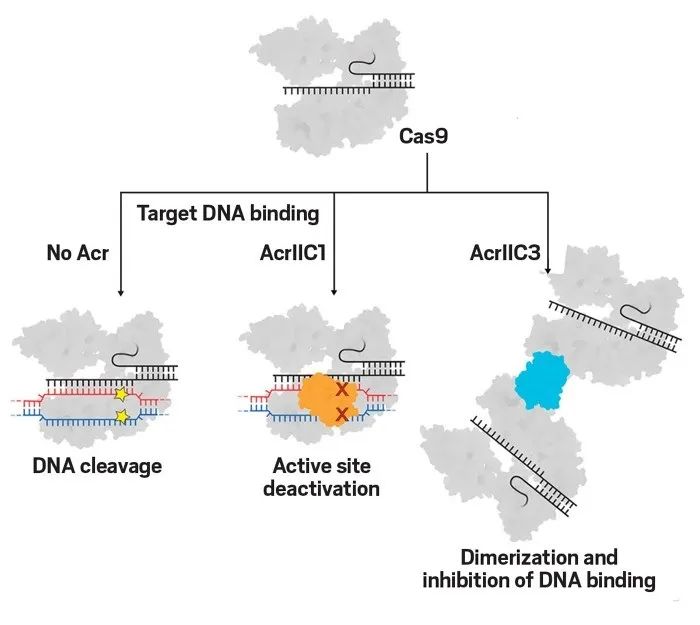
Credit: Adapted from Cell with permission from Elsevier
抗CRISPR蛋白使用不同机制抑制CRISPR-Cas9系统。AcrIIC1蛋白(橙色部分)与Cas9的活性位点结合并阻止酶在预期位置(星标处)剪切绑定的DNA。AcrIIC3蛋白(蓝色部分)诱导Cas9的二聚化,阻止其与目标DNA结合。
美国研究团队还表明,这一策略不仅在细胞中有效,在成年小鼠体内同样见效。“这是首次证明抗CRISPR可在活的成年哺乳动物体内组织中发挥作用,”该团队带头人Sontheimer说。
抗CRISPR还可帮助科学家控制基因驱动,这是使用CRISPR技术和其他基因编辑技术在群体中传播所需基因的一种技术。虽然研究者们希望基因驱动可通过消灭带病蚊子、蜱虫等增进公共健康,但基因驱动也引发人们对其潜在的、不可预期的环境影响的担忧。美国堪萨斯州立大学(Kansas State University)的研究人员证明使用抗CRISPR可中止酵母中的基因驱动,其活性降低了99.9%以上。
抗CRISPR甚至可能有助于消除人们关于CRISPR可能被用于针对人类或者环境的生物武器的恐惧。“如果我们拥有停止和调节CRISPR-Cas的好方法,它们就可能成为那些潜在生物恐怖事件的解药。” Pinilla Redondo说。
科学家已经开发出数种方案设计对CRISPR施加更多控制的抗CRISPR。如,2018年德国达姆斯塔特工业大学(the Technical University of Darmstadt)的分子生物学家Dominik Niopek及其同事将一个抗CRISPR与一个燕麦的光敏分子结合,作为使用光控制蛋白的“开关”的方法 (Nat. Methods, DOI: 10.1038/s41592-018-0178-9)。这一光遗传学方法让研究者们“在体外以精确的空间和时间控制CRISPR基因编辑”,Niopek说。此外,2019年Bondy-Denomy及其同事展示通过改变一个抗CRISPR,从而其进行化学控制,使其在缺少名为“Shield1”的小分子时失去稳定性,“Shield1”是一种常用于分解特殊标记蛋白质的化合物。(Nat. Commun., DOI: 10.1038/s41467-018-08158-x).
大多数抗CRISPR的一个局限是每个分子每次仅能抑制一个Cas蛋白。但在2019年,一支中国团队和一个美国团队分别发现抗CRISPR酶通过剪切其向导RNA可使一个Cas蛋白的多个副本失效。“这些酶抗CRISPR在生物学上可能有更多的潜在用途,” 美国爱荷华州立大学(Iowa State University )的生物化学家Dipali G. Sashital说,“可以想象下,使用这些可将所有Cas9蛋白快速关闭,相反使用其它抗CRISPR,则花费更长时间且需求量更大。”
抗CRISPR的未来
尽管有着潜力,然而抗CRISPR在治疗中的应用仍具不确定性。例如,虽然两种抗CRISPR已在小鼠的应用中证实其安全性,但在人体中是否会产生毒性或引发危险的免疫反应需要进一步的研究,Niopek说。
同时,科学家正在开发其他控制CRISPR的方法,例如使用小分子药物或修饰Cas酶使其通过光或者其他方式受到控制。抗CRISPR的最终价值区间可能是“从毫不重要到极为重要——现在很难对其预测,” Bondy-Denomy说。“CRISPR的控制是需要的——无论是通过抗CRISPR还是其他方式,最终我们将会看到。”
不过,抗CRISPR可能因几个方面从竞争者中脱颖而出。例如,Niopek称“抗CRISPR的一大优势在于其完全可遗传编码,故可以作为遗传回路的一部分”;化学抑制剂则无法如此使用。Bondy-Denomy进一步指出,用于抗CRISPR的基因与用于CRISPR-Cas的基因可同被编辑与传递,其他方式则需分别的传送方式,从而可能导致应用更复杂。
另一优势则是已知的数个抗CRISPR可抑制其目标Cas酶的多种变体。这种广谱活性可帮助科学家控制多样的CRISPR-Cas系统——无论是天然的还是编辑后的——而不必为所需应用重新设计每个Cas蛋白,Niopek说。此外,抗CRISPR机制的多样性意味着研究者可根据需求挑选和优化抗CRISPR,他补充道。
“小分子抑制剂会非常有效,因其应用简单而快速,” Sashital说。“但对于它们的特定Cas蛋白,抗CRISPR大多是具体的,而小分子抑制剂可能总有潜在的脱靶效应。当然,对于开发CRISPR抑制剂,同时探索二者才是对的。”
虽然抗CRISPR能否直接应用于临床仍是一个没有答案的问题,但是这些蛋白质也可间接帮助科学家开发疗法。如,Sontheimer及其同事要开发一种病毒递送机制,用CRISPR-Cas9同时治愈遗传疾病并破坏病毒载体自身,从而整个“递送组合“不会因存活太久而发生脱靶效应。但科学家使用细菌中培养的病毒的遗传物质制造了这些病毒,有时病毒DNA可能无意间产生了Cas9,并在研究人员将病毒用于实验前将病毒销毁。就好比试图将一罐罐硝化甘油(nitroglycerin)倒入瓶中,可能硝化甘油很容易自毁。
因此研究者加入一个抗CRISPR阻止Cas9识别目标病毒的DNA序列,从而在培养期间保护病毒。在预印本(bioRxiv 2020, DOI: 10.1101/2020.10.09.333997)中,他们展示出该病毒可在小鼠体内治疗两种遗传病,此后随时间推移自毁,降低了长期性副作用的风险。“抗CRISPR已被证实对于科研目的非常,非常有用,” Sontheimer说。
来源:ACS美国化学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyMjgzMzI0Ng==&mid=2247522911&idx=2&sn=35ec9b3b82b953a6b7ed11c2a5510450
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Nature: CRISPR开关可使基因编辑更安全

夫妻相真的存在,研究发现夫妻DNA相似度高过陌生人

感觉到了压力?你说的话比你自己更敏感
雄性和雌性为什么长得不一样?基因编辑成功解密

基因编辑有重大新进展!两大突破可高效精准矫正致病的遗传突变

FDA批准首款CRISPR基因编辑疗法

史上新高CRISPR基因编辑插入效率!
痘痘有救了?CRISPR基因编辑技术可以治愈痤疮!

英国批准应用全球首个CRISPR基因编辑疗法
CRISPR基因编辑婴儿的另一面:编辑胚胎基因组,治疗儿童疾病