科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-13
来源:BioArt
责编 | 兮
细胞核内染色质的三维空间结构是真核生物的共同特征。科学家们通过利用早期的普通光学显微镜到后来的电子显微镜,荧光显微镜,不断发现染色质的高级结构,并证实了其内在的分区的动态变化。转录因子及表观遗传调控因子被认为是调节并维持细胞间期染色质结构的重要组成部分。细胞发育过程需要经历不同基因表达时序的精密调控,以应对外界信号的刺激并维持自身稳态(homeostasis)。然而,染色质在基因组表达被激活时是如何实现特定位置间的运动机制还尚未被阐明。
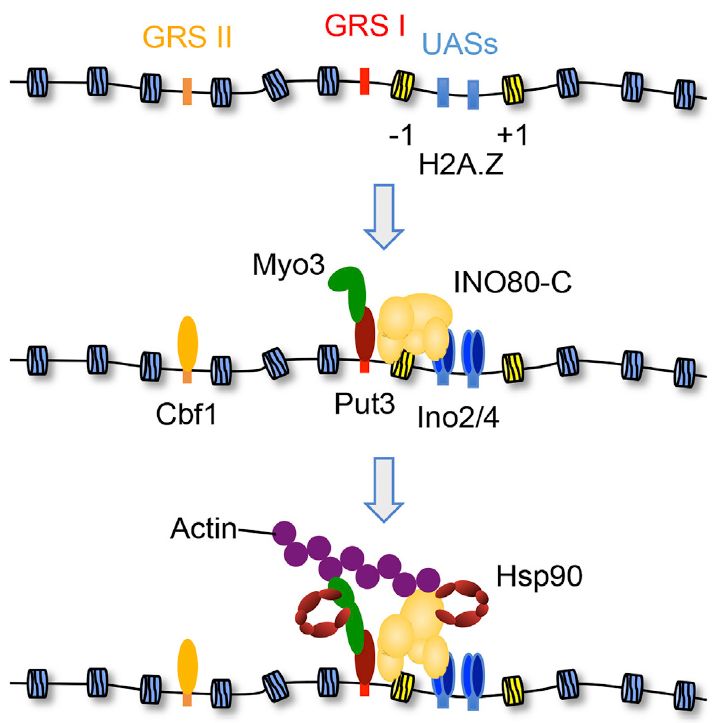
2020年1月2日,伊利诺伊大学香槟分校Brian Freeman教授实验室的王安琪博士在Developmental Cell杂志上发表文章 Mechanism of Long-Range Chromosome Motion Triggered by Gene Activation ,揭示了由细胞核分子伴侣蛋白,肌动蛋白,肌凝蛋白以及染色体重塑复合物共同调控细胞间期染色质基因位点特定运动的分子机理。

细胞间期染色质通常呈现两种运动模式:频发的短距离运动 (<0.2 m) 和偶发的长距离运动(>0.5 m)。虽然染色质的局限性扩散可以解释一部分短距离运动,但是长距离的运动则需要由ATP供能的信号通路调控。例如近年来的研究发现,在位于异染色质的基因修复过程中,DNA双链断裂处要经过长距离的位移到达细胞核边缘。这一运动过程需要利用由Arp2/3蛋白调控的肌动蛋白丝聚合,从而达到连接桥梁的作用。在酵母细胞中,一些代谢调控基因的激活与关闭也伴随着染色质在细胞核中央到边缘的位移。
王安琪博士等研究人员利用了荧光标记的INO1基因以及细胞核膜为模型对染色质运动的机理进行了探索。在超高分辨荧光显微镜下,他们观测到了INO1基因在激活之后以大约100nm/s的速度从细胞核中央运动到边缘。这一过程首先由转录因子复合物结合肌凝蛋白,从而聚合短片段的肌丝蛋白多聚体。这些游离在细胞核中的肌丝蛋白多聚体进而提供了染色质运动的路线桥梁。同时,肌动蛋白与肌丝蛋白的结合由包含INO80和SWR1在内的染色体重塑复合物稳固,并由广泛存在于细胞中的分子伴侣蛋白分子(chaperone)调节其活性。
这项新的研究发现首次将细胞核内染色质运动与短肌丝蛋白多聚体和染色体重塑复合物调节联系起来,进而对今后细胞核内染色质不同阶段的运动机理研究起到了推动作用。
原文链接:
https://doi.org/10.1016/j.devcel.2019.12.007
制版人:珂
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479846&idx=3&sn=d74a865d9574785aff341674f64e7a40&chksm=84e232d2b395bbc4edc26b2d3daf06e3f3ee1d325f114829d73df18c9045789b0c6e035da400&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

研究揭示胰腺癌染色质开放性特征
Cell丨抑制性染色质如何调控基因的转录?
解析病毒—宿主染色质“跨界互作”
植物染色质三维构象的深度解读

Cell : 破解异染色质细胞核周定位之谜

两年内发表多篇10+,他是如何做到的?

Cell:相分离调控染色质结构
红细胞染色质小体
论文导读——染色质重排、染色体破碎、线粒体DNA变化等
2019年度表观遗传与染色质生物学大会第一轮通知