科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-16
来源:BioArt
责编 | 兮
抑癌蛋白p53是细胞内最重要的肿瘤抑制蛋白之一,被誉为“基因组卫士”,在多种刺激情况下,p53都能被活化,诱导细胞发生周期阻滞、凋亡、衰老等,从而抑制肿瘤细胞的生长和增殖。因此,在生理条件下,MDM2等E3泛素连接酶降解p53蛋白,使p53蛋白保持在较低水平以维持正常的细胞功能。当发生DNA损伤时,MDM2和p53蛋白的结合减弱,p53蛋白的降解受到抑制而发生累积;活化的p53通过转录调控一系列蛋白的表达引起细胞周期阻滞,为DNA损伤修复提供时间。DNA损伤修复完成后,累积的p53蛋白必须被清除才能使细胞恢复正常的细胞周期进程。但是,目前的研究并不清楚活化的p53蛋白恢复到正常水平的具体机制以及相应的生物学效应。
2020年1月14日,浙江大学医学院附属第一医院、转化医学研究院赵永超课题组在Cell Reports杂志发表题为“FBXW7 Confers Radiation Survival by Targeting p53 for Degradation”的研究论文,该研究揭示了泛素连接酶FBXW7通过泛素化降解p53来调控肿瘤细胞放疗敏感性的新机制。

在这项研究中,研究者通过系统的分子生化实验发现,p53是SCFFBXW7 E3泛素连接酶新的生理底物:DNA损伤激活ATM,活化的ATM磷酸化位于p53蛋白N端的保守FBXW7降解结合位点(31VLpSPLPpS37),一方面分开p53与MDM2的结合,从而稳定p53,引起细胞周期阻滞,另一方面,促进FBXW7与p53的结合,从而启动p53的泛素化降解,最终促使活化的p53恢复到正常水平;生物学功能上,敲减FBXW7通过稳定p53蛋白,引发细胞周期G2/M阻滞和细胞凋亡,从而增强肿瘤细胞的放疗敏感性和依托泊苷的化疗敏感性(图1)。此外,密歇根大学放射肿瘤学系孙毅教授课题组在2016年的Molecular Cell上揭示了FBXW7通过K63链泛素化修饰活化XRCC4,增强NHEJ修复,从而导致放疗耐受(Zhang Q, et al. Mol Cell. 2016, 61:419-433)。因此,本研究进一步丰富了FBXW7调控放疗敏感性的分子机制。
另外, FBXW7被认为是一个经典的抑癌蛋白,其已知的降解底物,例如c-MYC、NOTCH、Cyclin E等,多为原癌蛋白,而本研究发现FBXW7新底物p53为经典的抑癌蛋白,增加了FBXW7调控的底物复杂性。本研究还发现FBXW7不仅可以降解野生型的p53,也可以降解突变型p53。有研究报道(Ulz P, Nat Genet. 2016, 48:104–106),在多种人类肿瘤中,p53突变和MYC蛋白高表达往往同时发生,因此,通过激活FBXW7,就能同时靶向降解两者,可能提供新的肿瘤治疗策略。
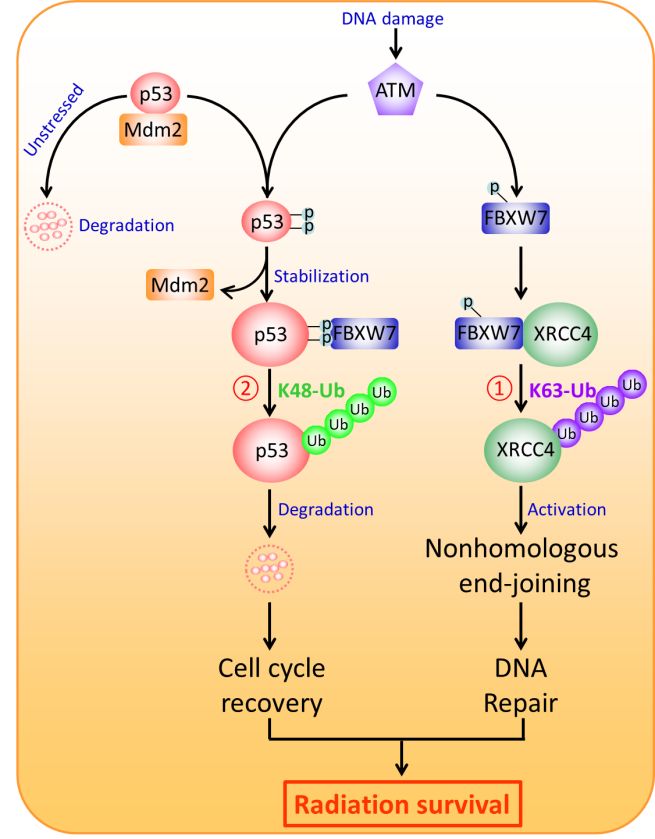
图1.FBXW7降解p53促进肿瘤细胞放疗存活
浙江大学附属第一医院崔丹蕊博士和浙江大学转化医学研究院熊秀芳副教授为该文共同第一作者,赵永超研究员为通讯作者。
原文链接:
https://doi.org/10.1016/j.celrep.2019.12.032
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479926&idx=5&sn=77d7a0b0dae8e4aa8c0cd6ee0e9976b1&chksm=84e23202b395bb146482974261dd110e09b078baedabda78f605df1d1ce6c7157fa4c01ad160&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
科学家创制首个植物E3泛素连接酶文库
“蛋结构”材料能有效杀伤肿瘤细胞

泛素连接酶COP1作为神经炎症“刹车”的机制

去泛素化酶OTUD5与泛素连接酶TRIM25协同作用调控肿瘤进程的相关机制
癌症演化树:揭示癌症转移机制


水生所揭示ELL作为E3泛素连接酶的新功能
中国科大揭示肿瘤细胞代谢重编程与周期调控新机制

泛素连接酶RIPLET激活RIG-I信号的新模式

李昕研究组发现两个泛素连接酶,可调节NLR受体蛋白的降解

青年科学家高大明:理解肿瘤、如何防癌