科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-01-16
来源:BioArt
责编 | 酶美
血管系统是脊椎动物机体中最早发育并行使重要生理功能的复杂系统。早期自发性血管发生(Vasculogenesis), 由成血管细胞发育成血管内皮细胞并最终形成血管的过程,对于胚胎发育至关重要; 而血管新生(Angiogenesis),是指从已有的毛细血管或毛细血管后静脉发展而形成新的血管, 则是一把双刃剑。一方面,生理性血管新生对于正常生长和发育以及女性生殖过程和伤口愈合至关重要。另一方面,病理性血管新生在异常血管生长中起重要作用,会导致多种人类疾病的发生,例如早产儿视网膜病变(ROP),糖尿病性视网膜病变,癌症和心血管疾病【1】。了解血管新生的分子机制对于开发有效的抗血管新生或促血管新生的治疗方法至关重要。
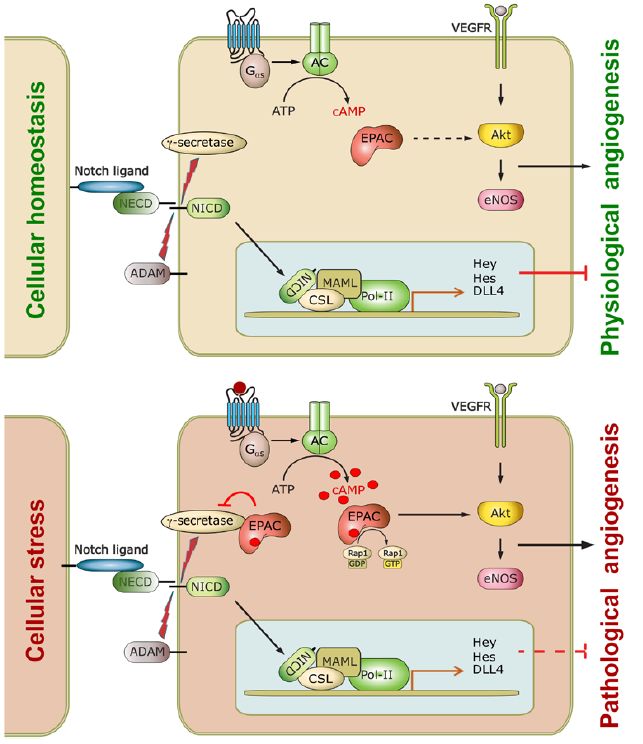
环腺苷酸(cAMP)是一种多效性的第二信使,它是重要的应激反应信号分子,可以调节许多生理和病理过程。Epac (cAMP直接激活的交换蛋白)是cAMP在细胞内主要的下游效应分子,独立于经典的cAMP受体蛋白激酶A(PKA)【2】。在哺乳动物中,Epac蛋白有两个亚型,即Epac1和Epac2,它们是鸟嘌呤核苷酸交换因子,可以激活下游的small GTPase (小鸟苷酸结合蛋白) Rap1和Rap2【3,4】。Epac1在体内分布广泛,经常参与病理发生,诸如心肌肥大和肥胖等;而Epac2主要参与生理过程,诸如胰岛素分泌,学习和记忆【5】。Epac1在血管中非常丰富,尤其是在内皮细胞(EC)中【6】, 研究表明Epac1信号可调节细胞粘附、迁移、连接形成和内皮屏障功能【7-10】。但Epac1在血管新生中的具体作用,目前仍不清楚。
近日, 来自美国德克萨斯大学休斯顿健康科学中心 (University of Texas Health Science Center at Houston, UTHSC)的程晓东实验室和德克萨斯大学医学分部(University of Texas Medical Branch, UTMB)的张文波实验室合作在Science Advances杂志上发表文章,Epac1 inhibition ameliorates pathological angiogenesis through coordinated activation of Notch and suppression of VEGF signaling.,该论文系统地揭示了Epac1信号传导在调控病理性血管新生中的关键作用和其作为新型治疗血管增生性疾病的可能性。

首先,研究人员在小鼠缺氧导致的视网膜病变模型(OIR)中发现 cAMP, Epac1在视网膜中的表达水平明显增加。利用Epac1基因敲除和野生型小鼠,研究人员在三种不同小鼠模型 (缺氧导致的视网膜病变模型, 颈动脉结扎的小鼠模型 (Ligated carotid artery assay) 以及基质胶栓实验模型 (Matrigel plug assay))中发现,Epac1基因的敲除显著降低了病理血管的新生。 有意思的是,Epac1基因敲除并没有影响小鼠视网膜生理性血管生成。研究人员进一步利用主动脉环体外实验 (Aortic ring assay) 发现,无论是Epac1的缺失还是抑制剂对Epac信号通路的抑制,芽生性血管新生 (Vascular sprouting) 都会减少。
接下来,研究人员进一步进行了机理研究。利用体外内皮细胞实验, 发现Epac1的激活剂 (007-AM)足以增强内皮细胞的血管新生特性 (包括内皮细胞的增殖,迁移和血管生成能力),从而导致病理性血管新生。相反,Epac的抑制剂则显著降低了由VEGF-或007-AM诱导的内皮细胞的增殖,迁移和血管生成。分子机制上, Epac的激活促进了VEGF 下游信号分子Akt和eNOS的激活;Epac1的敲除则抑制了基础水平的或者VEGF诱导的Akt和eNOS磷酸化。这些数据一起表明,Epac1激活可促进并与VEGF信号协同作用, 从而导致病理性血管新生。另一方面, Epac1沉默增加了Notch下游靶基因 Hes1和Hey1以及Notch配体DLL4的mRNA水平。相反, 007-AM对EC上Epac1的激活则下调了这些基因和相应蛋白的表达。进一步利用 Affinity Pull-down 实验,研究人员发现Epac1可以与γ-secretase 中的presenilin 1相互作用,调控γ-secretase的细胞内运输,从而抑制γ-secretase /Notch信号通路。 通过正反调控VEGF和 Notch这两条通路, Epac1最终促进了病理性血管的新生。
最后,研究人员评估了Epac抑制剂 (ESI-09) 治疗病理性血管新生的前景。从出生后12天 到16天, WT OIR小鼠腹腔内被注射Epac特异性抑制剂ESI-09 [20 mg kg-1 day-1] 。 类似于Epac1基因敲除小鼠,ESI-09显著降低了病理性血管新生。这一结果表明, Epac1是治疗病理性血管新生类疾病的一个有效靶点。
综上所述,在这项研究中,本文的作者们为我们详细地阐述了Epac1在内皮细胞上的功能。Epac1可以抑制γ-secretase/Notch信号通路,同时增强血管内皮生长因子(VEGF)的信号传导,从而促进了病理性而非生理性的血管新生。此外,作者们提供了Epac 抑制剂作为新型治疗血管增生性疾病的可能性。
美国德克萨斯大学医学分部刘华博士,德克萨斯大学休斯顿健康科学中心梅昉以及扬文利博士为本文的共同第一作者。德克萨斯大学休斯顿健康科学中心 (University of Texas Health Science Center at Houston)的程晓东教授和德克萨斯大学医学分部(University of Texas Medical Branch)的张文波教授为本文的共同通讯作者。
原文链接:
https://advances.sciencemag.org/content/6/1/eaay3566/tab-article-info
参考文献
1. P. Carmeliet, Angiogenesis in life, disease and medicine. Nature 438, 932-936 (2005).
2. X. Cheng, Z. Ji, T. Tsalkova, F. Mei, Epac and PKA: a tale of two intracellular cAMP receptors. Acta Biochim Biophys Sin (Shanghai) 40, 651-662 (2008).
3. J. de Rooij, F. J. Zwartkruis, M. H. Verheijen, R. H. Cool, S. M. Nijman, A. Wittinghofer, J. L. Bos, Epac is a Rap1 guanine-nucleotide-exchange factor directly activated by cyclic AMP. Nature 396, 474-477 (1998).
4. H. Kawasaki, G. M. Springett, N. Mochizuki, S. Toki, M. Nakaya, M. Matsuda, D. E. Housman, A. M. Graybiel, A family of cAMP-binding proteins that directly activate Rap1. Science 282, 2275-2279 (1998).
5. W. G. Robichaux, 3rd, X. Cheng, Intracellular cAMP Sensor EPAC: Physiology, Pathophysiology, and Therapeutics Development. Physiol Rev 98, 919-1053 (2018).
6. O. L. Roberts, C. Dart, cAMP signalling in the vasculature: the role of Epac (exchange protein directly activated by cAMP). Biochem Soc Trans 42, 89-97 (2014).
7. S. J. Netherton, J. A. Sutton, L. S. Wilson, R. L. Carter, D. H. Maurice, Both protein kinase A and exchange protein activated by cAMP coordinate adhesion of human vascular endothelial cells. Circ Res 101, 768-776 (2007).
8. M. R. Kooistra, M. Corada, E. Dejana, J. L. Bos, Epac1 regulates integrity of endothelial cell junctions through VE-cadherin. FEBS Lett 579, 4966-4972 (2005).
9. X. Cullere, S. K. Shaw, L. Andersson, J. Hirahashi, F. W. Luscinskas, T. N. Mayadas, Regulation of vascular endothelial barrier function by Epac, a cAMP-activated exchange factor for Rap GTPase. Blood 105, 1950-1955 (2005).
10. S. Fukuhara, A. Sakurai, H. Sano, A. Yamagishi, S. Somekawa, N. Takakura, Y. Saito, K. Kangawa, N. Mochizuki, Cyclic AMP potentiates vascular endothelial cadherin-mediated cell-cell contact to enhance endothelial barrier function through an Epac-Rap1 signaling pathway. Mol Cell Biol 25, 136-146 (2005).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652479926&idx=4&sn=ce1b24772d59154b5659e550fd6df68a&chksm=84e23202b395bb143159c9abc93fb924009b64f703fb8499092b4b086fb0aac70ebb03f7c6eb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

JOL论文推荐 | cAMP信号通路参与调节缺氮培养条件下莱茵衣藻细胞内油脂的生物合成
深圳先进院等实现用光学方法控制细菌的运动行为
新技术揭示成瘾过程中两种神经元的cAMP信号通变化机制
细菌的CAMP试验
CAMP试验
单细胞cAMP信号通路调控的光遗传学工具

Cell:cAMP分子被“绑架”才是导致cAMP信号区域化的根本原因
CAMP试验
Cell:中国学者揭示小儿肠炎的“罪魁祸首”——环状AMP(cAMP)信号受损

Blood:血小板反应蛋白-1通过调节血小板的cAMP信号促进止血