科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2022-03-16
昼夜节律机制调节哺乳动物的睡眠-觉醒周期、新陈代谢、免疫功能和繁殖等生理活动与外界24小时昼夜循环相协同,从而维持机体组织和细胞生理活动的动态平衡。节律紊乱通常被认为是机体加速衰老的重要诱因。然而,核心节律机制如何调控灵长类的衰老知之甚少。
3月15日,中国科学院动物研究所刘光慧研究组、中山大学项鹏研究组,与动物所曲静研究组合作,在Nucleic Acids Research上,在线发表了题为BMAL1 moonlighting as a gatekeeper for LINE1 repression and cellular senescence in primates的研究论文。该研究运用CRISPR/Cas9介导的基因编辑技术产生了BMAL1缺失的人干细胞和非人灵长类研究模型,揭示了核心节律蛋白BMAL1具有维持基因组稳定性、抑制转座子LINE1活化,并拮抗灵长类组织和细胞衰老的新型功能。
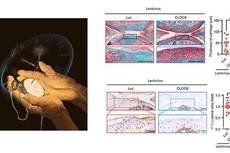
BMAL1是生物钟最核心的组分之一,作为转录因子在维持细胞分子生物钟和个体节律方面发挥重要作用。迄今为止,BMAL1蛋白在灵长类细胞稳态及衰老中的调控作用尚不明确。该研究发现人和猴细胞衰老过程中BMAL1逐渐从细胞核中排空,提示BMAL1可能与细胞衰老的基因表达调控相关。为探究BMAL1对灵长类细胞衰老的调控功能,科研人员结合CRISPR/Cas9介导的基因编辑技术和干细胞定向分化技术获得了BMAL1敲除的人间充质干细胞,进而发现BMAL1蛋白的缺失引起人间充质干细胞的加速衰老。虽然BMAL1依赖其转录活性参与节律调节,但野生型BMAL1及其转录活性丧失的突变体均可抑制BMAL1缺失所致人间充质干细胞加速衰老,说明BMAL1对衰老的调控不依赖经典的转录功能。机制研究发现,BMAL1与核纤层及异染色质蛋白结合,有助于维持异染色质的结构稳定性,进而抑制“跳跃基因”LINE1的活化。BMAL1的缺乏导致LINE1等“核酸垃圾”在胞浆内表达和聚集,进而诱导下游cGAS-STING天然免疫通路的激活,加速干细胞衰老。反转录酶抑制剂拉米夫定(Lamivudine)处理可有效抑制BMAL1缺失引起的细胞加速衰老。同时,研究表明BMAL1缺失的猴间充质干细胞及组织中也存在LINE1及cGAS-STING通路的激活,说明BMAL1抑制“垃圾核酸”积聚、稳定天然免疫通路的新功能在人和非人灵长类中保守。
该研究首次揭示了核心节律蛋白抑制LINE1-cGAS-STING通路进而调控灵长类衰老的新功能及新机制。这一成果拓展了关于核心节律蛋白生物学功能的认识,建立了昼夜节律和衰老调控的科学联系,为延缓灵长类衰老提供了新的分子靶标,并为防治衰老相关疾病开拓了新思路。
该工作由动物所、中山大学中山医学院、中科院北京基因组研究所、首都医科大学宣武医院、北京干细胞与再生医学研究院、北京协和医院、香港中文大学医学院等合作完成。研究工作得到科技部、国家自然科学基金、中科院及北京市等的支持。

衰老伴随的BMAL1核内利用度降低导致LINE1激活,进而加速细胞衰老
内容来源:中国科学院来源:中国科学院
原文链接:http://www.cas.cn/syky/202203/t20220315_4828329.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

肿瘤干细胞研究取得进展

Nat Cell Bio综述:干细胞疗法研究进展
科技创新热词解析:干细胞研究
中国首个干细胞通用标准发布,规范国内行业发展
研究揭示核心节律蛋白延缓干细胞衰老及促进再生的新功能
研究发现“双刃剑”肝脏干细胞

惊奇!新技术让小白鼠长出人类皮肤

美政府暂停心脏干细胞研究
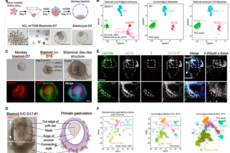
脑智卓越中心等利用胚胎干细胞建立非人灵长类类胚胎模型
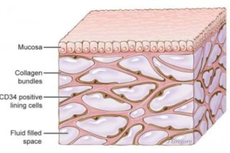
人体长期以来被忽略的“器官”——间质被重新发现