科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2022-08-16
 图1.P17标签提高了4种scFv在大肠杆菌SHuffle菌株中的溶解度
图1.P17标签提高了4种scFv在大肠杆菌SHuffle菌株中的溶解度 图2.P17标签提高了G12-scFv的热稳定性
图2.P17标签提高了G12-scFv的热稳定性来源:中国科学院
原文链接:http://www.cas.cn/syky/202208/t20220813_4844515.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

追踪植物细胞的膜蛋白
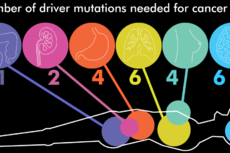
从健康细胞到癌细胞,或许只需要几个突变
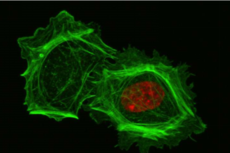
失去细胞核的细胞在3D环境中举步维艰
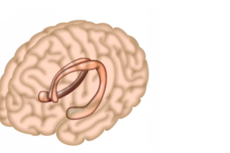
大脑中发现“焦虑细胞”,为治疗焦虑症提供新方向

新研究为化疗耐受相关细胞贴上“标签”
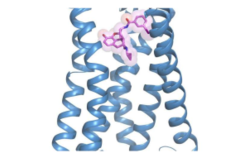
《细胞》发文!阿片类药物迎来重大突破

Nat Comm:p53蛋白乙酰化新的重要调控机制

细胞自噬关键蛋白突变可延寿

蛋白质上海设施用户发展YISEL亚基中位标签定位方法

植物基因功能研究中蛋白标签用对了吗?否则可能影响您的结果。