科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2023-03-24
2023年3月24日,上海交通大学Bio-X研究院陆青课题组与山东大学生命科学学院徐志刚课题组合作在Nature Communications在线发表了题为“Temporal and spatial assembly of inner ear hair cell ankle link condensate through phase separation”的研究论文,报道了内耳毛细胞USH2复合物时空组装的相分离调控机制。

听力障碍一直是医学和生命科学领域的难题。内耳毛细胞是听觉的关键机械感受器,具有复杂的组织结构和发育机制。静纤毛(stereocilia)是毛细胞上表面以肌动蛋白丝为骨架的阶梯状细胞突起,是机械-电转导发生的位置。如果静纤毛的形态被破坏或在发育过程中出现异常,会导致听力障碍。Usher综合征是临床上最常见的遗传性听力和视力障碍综合征,其中II型Usher综合征(USH2)致病基因WHRN、PDZD7、USH2A和ADGRV1编码的蛋白互相结合组成USH2复合物,对位于毛细胞静纤毛根部的踝连接(Ankle Link)至关重要。目前USH2蛋白复合物的整体组装机制以及USH2基因相关耳聋变异的致病机制尚不十分清楚。

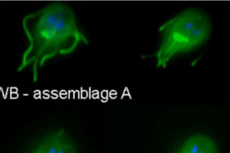
图1. 内耳毛细胞USH2复合体的时空组装机制
在本工作中,团队发现支架蛋白WHRN和PDZD7与跨膜蛋白ADGRV1和USH2A通过液液相分离(LLPS)完成USH2蛋白复合物的组装,从而调控毛细胞静纤毛的发育。WHRN/USH2A的多价相互作用驱动LLPS平台的形成,进一步招募PDZD7和ADGRV1形成凝聚体。有趣的是,高浓度的ADGRV1会抑制LLPS,从而导致USH2复合物的解离。这种时空特异性的组装可能在踝连接发育过程中发挥关键作用。在小鼠模型中的实验进一步证实了介导LLPS形成的多价互作的重要性,揭示了其对毛细胞发育可能的影响。更重要的是,在听力受损患者中发现的多个变异会削弱ADGRV1/WHRN/USH2A/PDZD7复合物的多价相互作用,从而破坏其相分离。从而证明,LLPS介导了USH2复合物的形成及其时空调控过程。液液相分离的破坏是造成听力障碍的重要致病机制之一。这项研究有望为深入了解内耳听觉功能提供新的启示,并为未来开发新的听力障碍治疗方案提供基础。
设施贡献
本工作获得蛋白质科学研究(上海)设施规模化蛋白质制备系统和复合激光显微成像系统的技术支持和机时保障。
用户利用规模化蛋白质制备系统等温滴定微量热仪测量蛋白/蛋白相互作用产生的热力学参数变化并进行拟合,获取蛋白之间相互作用的系列数据,并为其后续相分离实验的开展提供了重要基础。继而使用复合激光显微成像系统单光子激光共聚焦显微镜获取蛋白荧光(共定位)成像及荧光漂白后恢复图片等数据,证明了该课题所研究蛋白复合物的相分离现象。
原文链接:https://www.nature.com/articles/s41467-023-37267-5
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202307/t20230727_4580686.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
肠道寄生虫可以模仿人体产生蛋白来获取食物
循环免疫复合物(CIC)
《科学》:揭示哺乳动物线粒体复合物I的作用机制

揭示核小体结构对组蛋白修饰酶复合物的酶活调控及其分子机制

膜内分子伴侣复合物协助膜蛋白的生物合成

想用奖励鼓舞青少年?研究证明一点用也没有

简化蛋白质受体复合物研究的新方法

CLC-7/Ostm1转运蛋白复合物的结构和门控机制

简化蛋白质受体复合物研究的新方法
研究揭示钠氢逆向转运蛋白NHE3-CHP1复合物自抑制调控机制的结构基础