科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-02-27
来源:BioArt
原标题:Nature: 查珊等揭示DNA修复蛋白DNA-PK复合体在核糖体RNA加工及造血中的新功能DNA-dependent protein kinase(DNA-PK, 依赖DNA激活的蛋白激酶)由KU70-KU86 (Ku80 in mouse) 二聚体 (KU) 和催化亚单位(DNA-PKcs,catalytic subunit) 组成,是真核细胞DNA双链断裂修复过程中非同源末端连接(NHEJ)通路的重要成员【1】。
在NHEJ过程中,KU识别并紧密结合双链DNA末端 (包括hairpin DNA 末端),启动NHEJ,促进DNA连接酶Lig4-XRCC4-XLF复合体,PAXX等其它NHEJ通路成员在DNA断裂端的聚集,并同时激活DNA-PKcs的激酶活性。
自发性DNA-PKcs 缺失的小鼠发育正常,但没有成熟的B/T淋巴细胞,表现出严重自身免疫缺陷 (severe combined immunedeficiency,SCID ) 【2,3】 。九十年代对SCID小鼠的研究,揭示了NHEJ通路在淋巴细胞发育,特别是B/T淋巴细胞受体重组中的重要作用【1】。
因为不具备免疫排异性,SCID小鼠也成为研究人类肿瘤发展的重要载体。与完全不能启动NHEJ的KU缺失的小鼠不同,DNA-PKcs缺失的小鼠可以完成部分NHEJ,但不能打开带有发卡结构的DNA末端(hairpin ends)而对其进行修复。这是因为,DNA-PK通过一系列的磷酸化反应激活DNA内切酶Artemis,实现对hairpin DNA末端的处理,使连接可以顺利的进行。
淋巴细胞发育中产生的双链DNA末端恰恰带有hairpin 结构,解释了SCID小鼠的特异性免疫缺陷【4,5】。NHEJ不仅在淋巴细胞发育中有重要作用,对修复辐射物、化疗药物造成的DNA双链断裂都至关重要。
2020年2月26日,来自美国哥伦比亚大学的查珊课题组和来自麻省理工学院的Eliezer Calo课题组合作在Nature杂志在线发表了题为DNA-PKcs has KU-dependent function in rRNA processing and haematopoiesis的研究论文,在生理功能和生化水平上为DNA-PK打开了一个新的“以RNA为中心”的功能区,首次报道了DNA-PKcs在核糖体RNA加工过程中的作用以及因此对造血功能的影响。哥伦比亚大学查珊课题组的博士后邵正萍,朱义萌, 研究生Jennifer Crowe 和斯坦福大学的博士后Ryan Flynn为本文的共同第一作者。

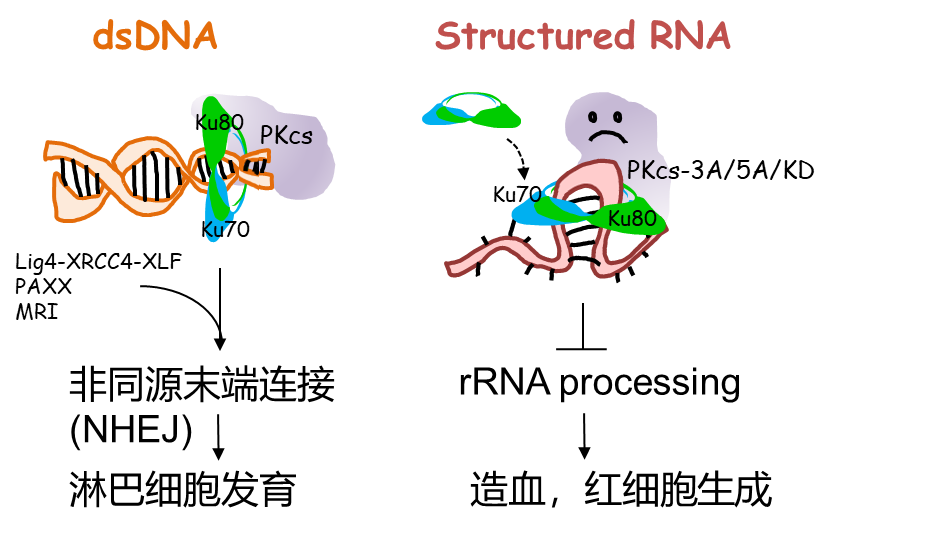
图1. DNA-PK 在RNA和DNA上的功能。
为了探讨DNA-PKcs激酶活性在NHEJ过程中的作用,查珊课题组在小鼠模型中引入了一个导致DNA-PKcs激酶活性缺失的点突变(D3922A,kinase-dead, KD)【6】。与DNA-PKcs缺失的小鼠不同,DNA-PKcs酶失活(KD)小鼠完全不能启动NHEJ,造成严重胚胎发育障碍。这项发表在Mol Cell 2015 的研究显示,一旦结合到断裂DNA末端,DNA-PKcs的激酶活性为完成NHEJ所必需【6】。
敲除P53之后,DNA-PKcs酶失活小鼠得以完成胚胎发育,但仍在出生后40天左右死亡,而其它NHEJ/P53缺陷小鼠,则于出生后100天左右患恶性淋巴瘤。那么,DNA-PKcs酶失活的小鼠,为何与其它NHEJ缺陷小鼠表型不同?这是否说明,除了在NHEJ通路中的功能外,DNA-PKcs还具有其它的功能呢?
在对P53缺陷的DNA-PKcs酶失活小鼠的研究过程中,研究人员发现早期死亡的小鼠并非死于常见的淋巴瘤,也没有备用DNA末端连接通路 (alternative DNA end-joining pathway) 的缺陷【7】,骨髓和脾脏的病理学分析却显示出了骨髓增生异常综合征 (MDS) 的特点,提示DNA-PKcs酶失活蛋白可能对造血系统产生除了NHEJ之外的其它影响。激活的DNA-PKcs会引发自身磷酸化 (auto-phosphorylation)而调节它在DNA末端的高级构象【8】。
为进一步了解DNA-PKcs自身磷酸化在造血发育过程中的作用,研究人员对DNA-PKcs的两个主要的自身磷酸化位点进行了突变(T2609 和S2056 ),建立了磷酸化位点突变的小鼠模型。查珊课题组和德克萨斯州西南医学中心的David Chen 和Benjamin Chen研究组【9】 都发现T2609A磷酸化位点突变(5A or 3A)的小鼠表现出严重贫血及血小板减少的特征。
查珊课题组在流式分析中发现,DNA-PKcs-T2609A小鼠肧胎肝脏及幼年小鼠骨髓中的Lin-Sca1+c-Kit+的造血干细胞数量显著减少,但却没有典型NHEJ缺陷导致的淋巴细胞受体发育缺陷。
他们更进一步发现,敲除KU,抑制了NHEJ, 却可以完全纠正贫血,说明变异的DNA-PK 可能通过KU结合到其它形式的核酸上而妨碍造血。此前研究提示,纯化的KU也可以和双链RNA短暂结合。在没有外源性DNA损伤的哺乳动物细胞中,部分KU可以通过RNA聚集在核仁(nucleoli)中【10】。
核仁是核糖体RNA转录成熟的主要场所。造血干细胞和红细胞发育高度依赖于核糖体RNA和蛋白质翻译的精准调控【11】。核糖体合成障碍在病人身上导致先天性的纯红再生障碍性贫血(又名Diamond-Blackfan Anemia,DBA)【12】。在这个基础上,查珊课题组发现DNA-PKcs也像KU一样聚集在核仁,带有DNA-PKcs磷酸化位点突变的小鼠呈现出DBA病人特有的大细胞性贫血和幼红细胞发育障碍,各期早幼红细胞蛋白合成能力都有明显下降,核糖体RNA的成熟也受到不同程度的影响。而敲除KU缓解了核糖体RNA的成熟缺陷和红细胞发育障碍。
综上所述,该文报道了经典NHEJ修复通路关键蛋白KU和DNA-PKcs复合物在DNA双链断裂修复通路之外的,核糖体RNA加工和成熟过程中的重要作用。这种作用通过DNA-PKcs的第T2609位的磷酸化介导,而该位点的磷酸化障碍会导致rRNA和蛋白质合成障碍,严重影响造血系统的发育和成熟,导致再生障碍性贫血的发生并影响机体的生存。由于DNA-PK缺失本身在小鼠上并不导致贫血, 野生型DNA-PK在RNA加工中的作用还有待进一步研究。这一研究提示了造血系统疾病中新的病理机制,并提示双链DNA结合蛋白,可能在双链RNA加工中有未知的作用。
于此同时,MIT的Calo实验室专注于核糖体RNA加工的机理。他们在分离U3核仁小分子RNA(U3 snoRNA)结合蛋白的过程中,意外地发现了KU和DNA-PKcs。通过红外交联及免疫沉淀,Calo 课题组进一步确定KU和DNA-PKcs在U3上的结合位点,并在人源细胞上鉴定了能与KU-DNA-PKcs结合的RNA。模拟结果显示KU和DNA-PKcs主要与U3上的一个特定的双链RNA stem loop (U3-SL1)结合。该结构位于和18S rRNA成熟相关的保守区域。U3-SL1可以和纯化的KU-DNA-PKcs结合,并导致DNA-PKcs T2609 磷酸化,却并不能引导其它主要磷酸化位点(S2056)的磷酸化,证明了T2609位的磷酸化在核糖体形成中的重要作用。
原文链接:https://doi.org/10.1038/s41586-020-2041-2参考文献
1. Lieber, M.R. The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway. Annu Rev Biochem 79, 181-211 (2010).
2. Kirchgessner, C.U. et al. DNA-dependent kinase (p350) as a candidate gene for the murine SCID defect. Science. 267, 1178-1183 (1995).
3. Gao, Y. et al. A targeted DNA-PKcs-null mutation reveals DNA-PK-independent functions for KU in V(D)J recombination. Immunity. 9, 367-376 (1998).
4. Ma, Y., Pannicke, U., Schwarz, K. & Lieber, M.R. Hairpin opening and overhang processing by an Artemis/DNA-dependent protein kinase complex in nonhomologous end joining and V(D)J recombination. Cell 108, 781-794 (2002).
5. Moshous, D. et al. Artemis, a novel DNA double-strand break repair/V(D)J recombination protein, is mutated in human severe combined immune deficiency. Cell 105, 177-186 (2001).
6. Jiang, W. et al. Differential phosphorylation of DNA-PKcs regulates the interplay between end-processing and end-ligation during nonhomologous end-joining. Mol Cell 58, 172-85 (2015).
7. Crowe, J.L. et al. Kinase-dependent structural role of DNA-PKcs during immunoglobulin class switch recombination. Proc Natl Acad Sci U S A (2018).
8. Cui, X. et al. Autophosphorylation of DNA-dependent protein kinase regulates DNA end processing and may also alter double-strand break repair pathway choice. Mol Cell Biol 25, 10842-52 (2005).
9. Zhang, S. et al. Congenital bone marrow failure in DNA-PKcs mutant mice associated with deficiencies in DNA repair. J Cell Biol 193, 295-305 (2011).
10. Britton, S., Coates, J. & Jackson, S.P. A new method for high-resolution imaging of Ku foci to decipher mechanisms of DNA double-strand break repair. J Cell Biol 202, 579-95 (2013).
11. Signer, R.A., Magee, J.A., Salic, A. & Morrison, S.J. Haematopoietic stem cells require a highly regulated protein synthesis rate. Nature 509, 49-54 (2014).
12. Raiser, D.M., Narla, A. & Ebert, B.L. The emerging importance of ribosomal dysfunction in the pathogenesis of hematologic disorders. Leuk Lymphoma 55, 491-500 (2014).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652481508&idx=2&sn=b1d2889a133b7f98c2e9d3bce9deab0c&chksm=84e23450b395bd46fc2a9f1205874e6374151725e5051c29d1889c5beeae8f24d891be1b1414#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
Dev Cell :刘延盛组发现磷酸化修饰对蛋白质表达稳定性的影响
植物所揭示叶绿体核糖体RNA甲基化修饰的机制和功能

睡眠会增加染色体运动,从而减少DNA损伤 |《自然-通讯》

Mol Cell:程净东等揭示RNA外切酶体参与90s核糖体前体的切割
新冠病毒侵染的磷酸化蛋白质组全景图
研究揭示叶绿体核糖体RNA甲基化修饰的机制和功能

化学小分子诱导靶标蛋白质去磷酸化

NAR : 中科院植物所研究团队揭示叶绿体核糖体RNA甲基化修饰的机制和功能
核糖体RNA
染色质磷酸化蛋白质组学揭示PAMP触发免疫中核定位蛋白AHL13的功能!