科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-10
来源:BioWorld
2010年,年仅5岁的小女孩Emily Whitehead不幸罹患B细胞急性淋巴性白血病,在接受了16个月化疗后复发,她的父母在走投无路的情况下,于2012年4月接受了一种当时还处于探索阶段的全新癌症疗法——嵌合抗原受体T细胞疗法,也就是现在大名鼎鼎的CAR-T。这是世界上第一例CAR-T细胞治疗临床案例,接受CAR-T治疗后的Emily很快痊愈,体内癌细胞完全消失,如今,Emily已经15岁了,她的父母成立了Emily Whitehead命名的基金会,致力于帮助那些儿童癌症患者。2017年8月30日,FDA批准诺华公司(Novartis)的CAR-T疗法Kymriah(CTL-019)上市,人类进入CAR-T细胞治疗元年。 Emily Whitehead的CAR-T治疗方案,由宾夕法尼亚大学 Carl June 教授主导,Carl June 教授如今已成为CAR-T领域最炙手可热的人物。2020年2月28日,Carl June 教授领导的一项新的CAR-T临床试验登上了国际顶尖学术期刊 Science 杂志封面。这是第一个多重CRISPR/Cas9编辑工程改造的T细胞进行癌症治疗的人类临床试验,实验结果表明了该疗法在难治性癌症患者中的安全性和可行性。在此之前,我国的华西医院、杭州市肿瘤医院等单位进行了多项基于CRISPR/Cas9敲除T细胞上PD-1来治疗肿瘤的临床试验,但均以失败告终。
Emily Whitehead的CAR-T治疗方案,由宾夕法尼亚大学 Carl June 教授主导,Carl June 教授如今已成为CAR-T领域最炙手可热的人物。2020年2月28日,Carl June 教授领导的一项新的CAR-T临床试验登上了国际顶尖学术期刊 Science 杂志封面。这是第一个多重CRISPR/Cas9编辑工程改造的T细胞进行癌症治疗的人类临床试验,实验结果表明了该疗法在难治性癌症患者中的安全性和可行性。在此之前,我国的华西医院、杭州市肿瘤医院等单位进行了多项基于CRISPR/Cas9敲除T细胞上PD-1来治疗肿瘤的临床试验,但均以失败告终。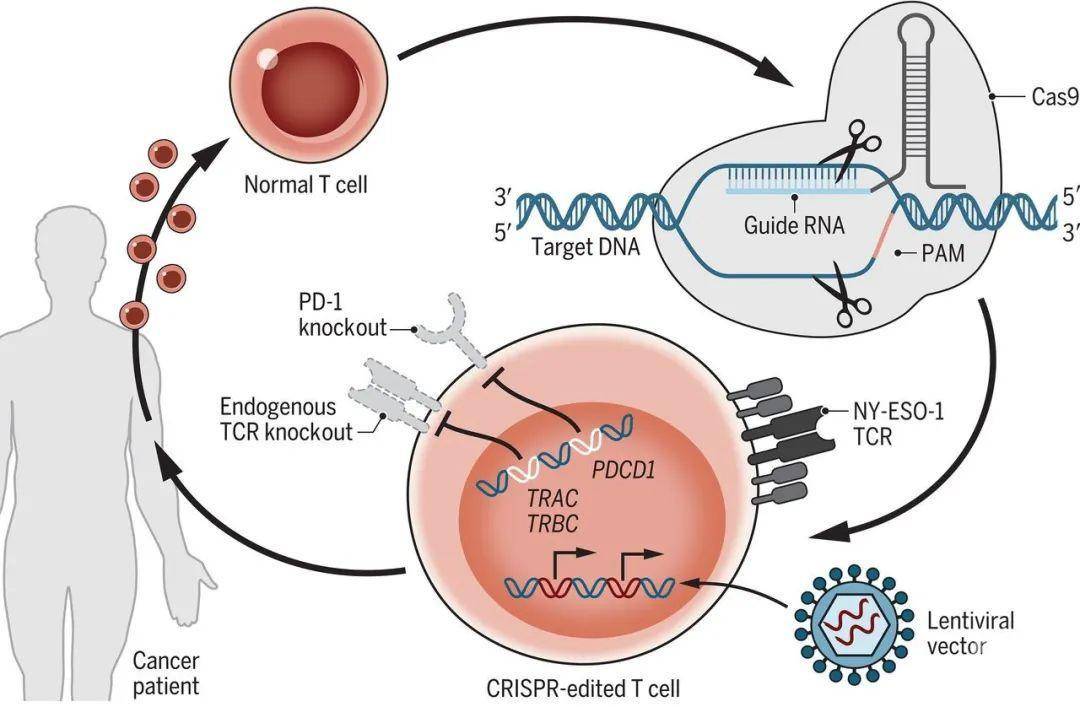 基因编辑结果表明,这三种基因编辑敲除的效率分别为:TRAC基因(45%)、TRBC基因(15%)、PDCD1基因(20%)。体外实验表明,经过多重CRISPR基因编辑的T细胞能够有效杀伤肿瘤细胞。进一步将工程化的T细胞输回病人体内,三名病人均表现出良好耐受性,没有出现CAR-T治疗中最常见的副作用——细胞因子风暴。且基因修饰的工程化T细胞平均半衰期长达83.9天。这项临床试验结果表明了使用CRISPR基因编辑T细胞多个基因在癌症治疗中的安全性和可行性,为基于CRISPR基因编辑的下一代细胞疗法铺平了道路。
基因编辑结果表明,这三种基因编辑敲除的效率分别为:TRAC基因(45%)、TRBC基因(15%)、PDCD1基因(20%)。体外实验表明,经过多重CRISPR基因编辑的T细胞能够有效杀伤肿瘤细胞。进一步将工程化的T细胞输回病人体内,三名病人均表现出良好耐受性,没有出现CAR-T治疗中最常见的副作用——细胞因子风暴。且基因修饰的工程化T细胞平均半衰期长达83.9天。这项临床试验结果表明了使用CRISPR基因编辑T细胞多个基因在癌症治疗中的安全性和可行性,为基于CRISPR基因编辑的下一代细胞疗法铺平了道路。 Carl June 教授论文链接:https://science.sciencemag.org/content/367/6481/eaba7365.abstract
Carl June 教授论文链接:https://science.sciencemag.org/content/367/6481/eaba7365.abstract来源:ibioworld BioWorld
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247497660&idx=5&sn=b1cc63698f7e38f73a50e9899669b252&chksm=fbf60369cc818a7fa261d92ee394a7701b2689d3d279b415a596520a17e93563073d04ecb74d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

精准基因工程技术
第22届全国肿瘤防治宣传周启动仪式在北京举行



哈佛大学医学院Kucherlapati教授访问中国抗癌协会


世界首例!CRISPR基因编辑在活体动物上成功治疗癌症,且长期有效

美国首例!CRISPR基因编辑技术应用于癌症治疗
科学家建立规模化抗肿瘤基因工程巨噬细胞技术
基因编辑治疗癌症新突破:浙大吕志民团队等通过CRISPR抑制肿瘤生长

Science:基因编辑先前Doudna盛赞:CRISPR治疗癌症是安全有效的
第十四届海峡两岸肿瘤学术会议在台北成功召开




史上新高CRISPR基因编辑插入效率!