科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-03-30
来源:BioArt
撰文 | 十一月
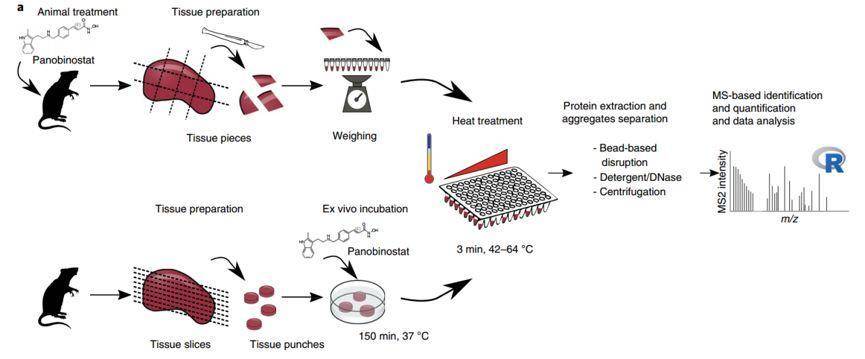 图1组织热蛋白质组分析在体内的应用流程图
图1组织热蛋白质组分析在体内的应用流程图参考文献
1. Bantscheff,M., Lemeer, S., Savitski, M. M. & Kuster, B. Quantitative mass spectrometryin proteomics: critical review update from 2007 to the present. Analytical and bioanalytical chemistry 404, 939-965,doi:10.1007/s00216-012-6203-4 (2012).2. MartinezMolina, D. et al. Monitoring drugtarget engagement in cells and tissues using the cellular thermal shift assay. Science 341, 84-87, doi:10.1126/science.1233606 (2013).3. Savitski,M. M. et al. Tracking cancer drugs inliving cells by thermal profiling of the proteome. Science 346, 1255784,doi:10.1126/science.1255784 (2014).4. Savitski,M. M. et al. Multiplexed ProteomeDynamics Profiling Reveals Mechanisms Controlling Protein Homeostasis. Cell 173, 260-274 e225, doi:10.1016/j.cell.2018.02.030 (2018).5. Ishii,T. et al. CETSA quantitativelyverifies in vivo target engagement of novel RIPK1 inhibitors in variousbiospecimens. Scientific reports 7, 13000,doi:10.1038/s41598-017-12513-1 (2017).6. vande Poll, M. C., Soeters, P. B., Deutz, N. E., Fearon, K. C. & Dejong, C. H.Renal metabolism of amino acids: its role in interorgan amino acid exchange. Am J Clin Nutr 79, 185-197, doi:10.1093/ajcn/79.2.185 (2004).7. Reinhard,F. B. et al. Thermal proteomeprofiling monitors ligand interactions with cellular membrane proteins. Nat Methods 12, 1129-1131, doi:10.1038/nmeth.3652 (2015).8. Tan,C. S. H. et al. Thermal proximitycoaggregation for system-wide profiling of protein complex dynamics in cells. Science 359, 1170-1177, doi:10.1126/science.aan0346 (2018).9. Gao,B., Wang, H., Lafdil, F. & Feng, D. STAT proteins - key regulators ofanti-viral responses, inflammation, and tumorigenesis in the liver. J Hepatol 57, 430-441, doi:10.1016/j.jhep.2012.01.029 (2012).来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652482750&idx=5&sn=d30c287b32b20c0bc179534df156f36a&chksm=84e23f0ab395b61c07e7c503661674e88f1f182d54a05f80791f8b71a6d6211eb4a8260b092d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Cell | 中科院生物物理所张宏组再一次突破,在自噬领域取得重大进展
Nature子刊:利用蛋白质快速光化学氧化与质谱连用解析蛋白质高级结构

新研究发现影响哮喘的关键蛋白质

简化蛋白质受体复合物研究的新方法

蛋白质设施用户解析新的转录调控复合物INTAC结构并揭示其功能

自然中不存在的蛋白质也能人造了!撼动材料医药界

吃了这么多年鸡蛋,才知道这10种蛋要少吃!第一个你就经常吃
铁氧反应为科学家提供了肺癌治疗新思路
蛋白质之间发生了什么?

煮粥、炖肉那层泡沫到底要不要撇掉?90%的人都做错了