科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-04-20
来源:中国生物技术网
北京时间4月16日凌晨,西湖大学在Science Advances期刊发表了人源氨基酸转运蛋白复合物b0,+AT-rBAT的最新研究成果,揭开了胱氨酸尿症发病的分子机理。西湖大学周强实验室博士后鄢仁鸿博士、清华大学博士生李雅宁、黄晶实验室博士后施仪博士为本篇论文的共同第一作者,西湖大学研究员周强与黄晶为通讯作者。

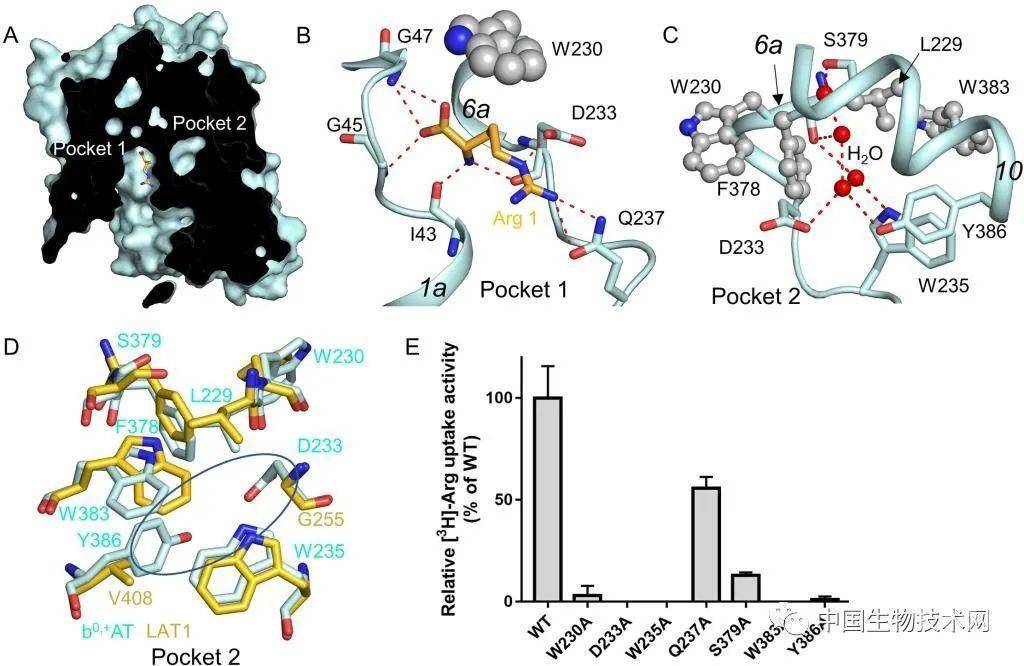 b0,+AT-rBAT复合物的底物结合和转运机制研究示意图在底物结合点附近,科研团队还鉴定出了底物结合位点附近的一个转运调控区域。通过点突变和同位素转运实验,他们证明了该转运调控区域对于b0,+AT-rBAT的转运功能至关重要。西湖大学黄晶实验室采用了分子模拟的方式,亦验证了该区域的重要性。对于b0,+AT-rBAT复合物突变而导致的胱氨酸尿症,基于上述研究,研究团队进一步揭开了该疾病发生的机理。通过分析已解析出的b0,+AT-rBAT的高分辨率结构,研究人员对突变的位点进行了准确定位,并对这些位点进行了体外生化实验的验证。结果显示,b0,+AT-rBAT的关键位点的突变影响了氨基酸转运的活性,造成了胱氨酸尿症。本次研究是西湖大学周强实验室在人源氨基酸转运蛋白领域取得的又一研究成果。周强实验室2019年发表了HAT家族的LAT1-4F2hc复合物的冷冻电镜结构,2020年解析了SLC6家族的中性氨基酸转运蛋白B0AT1(SLC6A19)与ACE2的复合物的冷冻电镜结构。
b0,+AT-rBAT复合物的底物结合和转运机制研究示意图在底物结合点附近,科研团队还鉴定出了底物结合位点附近的一个转运调控区域。通过点突变和同位素转运实验,他们证明了该转运调控区域对于b0,+AT-rBAT的转运功能至关重要。西湖大学黄晶实验室采用了分子模拟的方式,亦验证了该区域的重要性。对于b0,+AT-rBAT复合物突变而导致的胱氨酸尿症,基于上述研究,研究团队进一步揭开了该疾病发生的机理。通过分析已解析出的b0,+AT-rBAT的高分辨率结构,研究人员对突变的位点进行了准确定位,并对这些位点进行了体外生化实验的验证。结果显示,b0,+AT-rBAT的关键位点的突变影响了氨基酸转运的活性,造成了胱氨酸尿症。本次研究是西湖大学周强实验室在人源氨基酸转运蛋白领域取得的又一研究成果。周强实验室2019年发表了HAT家族的LAT1-4F2hc复合物的冷冻电镜结构,2020年解析了SLC6家族的中性氨基酸转运蛋白B0AT1(SLC6A19)与ACE2的复合物的冷冻电镜结构。来源:biotech-china 中国生物技术网
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5ODU5NDgyMg==&mid=2653948259&idx=2&sn=0fa3cbf9c0357e3130710b970d1c053f&chksm=bd0cf90a8a7b701c84733a516596e8d3309f6968f939c5ab7e0b7febd7b8746a334623c2ecd4#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

比生物界“AlphaGo”更厉害的模型来了?
不对称合成γ-氨基酸和γ-氨基磷酸衍生物

Nature | 邹伟平组揭示铁死亡在肿瘤免疫治疗中的作用
胱氨酸检查
蛋白质、氨基酸分解产物试验
研究揭示人线粒体丙氨酰-tRNA合成酶识别tRNA独特机制
氨基酸自养生物
肠上皮产生特殊氨基酸调控睡眠

一种氨基酸水平影响乳腺癌扩散
氨基酸的检查