科技工作者之家
科界APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-17
来源:BioArt
错误折叠的蛋白质多聚体(例如帕金森氏病相关的α-突触核蛋白纤维)在细胞间扩散是许多神经退行性疾病的重要病理学标志,而细胞内吞蛋白多聚体或者纤维样蛋白则是这种细胞间蛋白传递的关键环节。目前尚不清楚哺乳动物细胞如何内吞纤维样蛋白并引发致病蛋白在细胞间的传播。
近日,来自美国国立卫生研究院(NIH)的叶一泓 (Yihong Ye) 博士团队在PNAS发表了新发现:A myosin-7B–dependent endocytosis pathway mediates cellular entry of α-synuclein fibrils and polycation-bearing cargos(文章第一作者张琦博士和徐悦博士)。研究团队通过使用遗传学,生物化学,结构模拟和超高分辨率荧光成像技术发现了全新的α-突触核蛋白纤维蛋白的细胞内吞机制。他们的研究表明,α-突触核纤维蛋白通过一条为带有正电荷的内吞底物量身定制的内吞途径进入细胞。这些底物通过正负电荷间的相互作用与细胞表面的硫酸乙酰肝素蛋白聚糖结合,然后在肌球蛋白-7B和肌动蛋白丝的帮助下形成内吞体从而进入细胞。这一发现进一步加深了人们对帕金森等神经退行性疾病致病机理的理解并提供了相关靶点抑制药物开发的新方向。


容易错误折叠的α-突触核蛋白(α-Syn)在细胞间的传播已成为帕金森氏病的关键病理标志。这一病理过程的关键机理在于α-突触核蛋白聚合纤维可以通过网格蛋白介导的内吞途径进入细胞,但其潜在的分子机理尚不清楚。通过使用高通量CRISPR介导的遗传敲除筛选发现了3'-磷酸腺苷5'-磷酸硫酸转运蛋白1(SLC35B2)和肌球蛋白-7B(MYO7B)是α-突触核蛋白纤维内吞的关键调节因子。
团队发现SLC35B2是硫酸乙酰肝素蛋白聚糖(HSPG)在细胞内合成的关键因子,而HSPG则在将α-突触核蛋白纤维募集到细胞表面上起着至关重要的作用。通过进一步的生物仿真建模研究,研究团队发现α-突触核蛋白上带正电荷的氨基酸侧链组合(K-T-K), 只有在α-突触核蛋白形成纤维多聚体的情况下可以与细胞表面带负电荷的硫酸乙酰肝素蛋白聚糖(HSPG)通过离子键有效结合,从而聚集在细胞表面并引发内吞。体外细胞和神经细胞实验进一步证明失去K-T-K 组合的α-突触核纤维蛋白无法有效聚集到细胞表面,因而无法被内吞。α-突触核蛋白纤维与细胞表面受体HSPG相互间的分子作用机制的发现将为抑制该蛋白在帕金森病人体内的传播提供了新的药物设计靶点和治疗方向。
为了在活细胞荧光成像下直接观察HSPG介导的内吞,叶一泓团队发明了用带正电荷的绿色荧光蛋白来标记示踪HSPG。他们的研究显示,在与细胞表面结合后,带正电荷的绿色荧光蛋白迅速聚集成斑块。这表明HSPG在与配体结合后可能发生聚和。之后绿色荧光蛋白以网格蛋白包裹的内吞体的形式迅速进入细胞。但与以往研究的经典网格蛋白介导的内吞(例如转铁蛋白的内吞)不同的是, HSPG介导的内吞除了需要经典内吞的一些调控因子(诸如网格蛋白), 还对肌球蛋白-7B(MYO7B)和肌动蛋白有特殊的依赖性。超分辨率荧光显微镜研究表明MYO7B可以通过维持与细胞膜相关的肌动蛋白网络来控制细胞表面膜动力学。如果没有MYO7B或肌动蛋白丝的帮助,细胞膜失去“流动性”, 导致许多网格蛋白包裹的下凹无法从细胞膜上脱离成为内吞体,从而导致网格蛋白在细胞表面形成 “疤痕” 样累聚。在这种情况下,象α-突触核蛋白纤维这样的HSPG底物则很难进入细胞。至于为什么只有带阳性电荷的HSPG底物才会在内吞过程中需要MYO7B和肌动蛋白丝,作者认为可能是因为在网格蛋白介导的内吞过程中, 细胞膜的内陷导致底物和HSPG分子间彼此靠近。这会增加带有相同电荷的分子之间的排斥力, 因而需要MYO7B和肌动蛋白丝提供额外的能量来克服由此给膜弯曲带来的障碍。
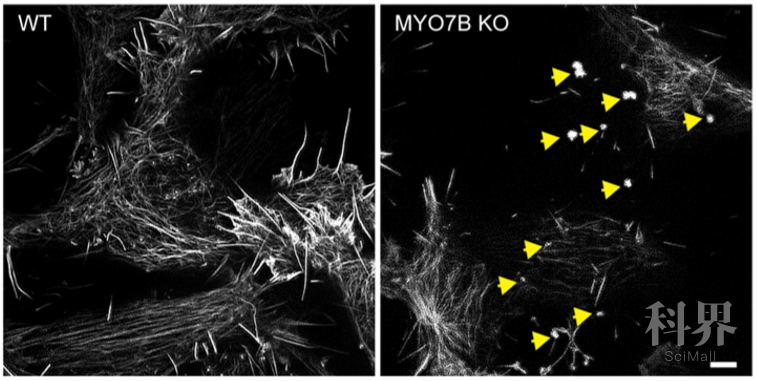
综上所述, 作者们的研究不仅定义了新的α-突触核蛋白纤维内吞的调控因子,而且揭示了α-突触核蛋白纤维与HSPG结合的相互作用机制并由此展示了一条新的细胞内吞通路。而这一通路适用的底物除了上面提到的致病蛋白α-Syn,还包括许多象病毒这样的病原体。由此可见,进一步研究HSPG 介导的细胞内吞机制, 阐明其它参与的调控因子,不仅有助与探索神经退行性疾病的治疗新途径,也有可能帮助找到新的广谱抗病毒药物。
原文链接:https://www.pnas.org/content/early/2020/05/01/1918617117#sec-9来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652485004&idx=6&sn=3794f34454a728d21ec0ec839c38a6e5&chksm=84e22638b395af2ea255c9f64ca74bef11f475dd0238b752fd761056a6a7fcf0bf534da9f2da&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

《细胞》重磅:太狡猾!癌细胞竟会用免疫细胞蛋白伪装自己,躲过免疫疗法攻击

研究发现谷氨酸受体信号肽在神经突触信息传递中的新功能----中国科学院

追踪植物细胞的膜蛋白

喷墨印刷可拉伸低压晶体管阵列,模拟突触间信息传递!

靶向蛋白降解药物:细胞内做“猎头”,“借刀”灭掉致病蛋白

人体细胞内存在“铁路”系统,能自动优化结构
大脑中发现“焦虑细胞”,为治疗焦虑症提供新方向

人工细胞与生物细胞首次实现成功融合与协作
细胞角质蛋白19片段
科学家发现突触可双向传递信息