科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-05-19
来源:BioArt
撰文 | 木兰之枻
责编 | 兮
CRISPR-Cas9系统的出现为基因组编辑和基因表达调控研究带来了革命性的变化。其基因组编辑的基本原理是,Cas9蛋白在特定sgRNA的引导下,切割目标位点引入DNA双链断裂(DSBs),之后经由非同源重组修复(NHEJ)或同源重组修复(HDR)途径实现目标基因的编辑。考虑到CRISPR-Cas9系统的便捷和高效,其在基础研究和临床应用的使用日益广泛。不过,作为外源系统,其潜在的安全风险也广受关注。2018年,有研究者指出,CRISPR-Cas9系统能激活p53而引发DNA损伤,而活化的p53则会抑制CRISPR-Cas9系统的基因编辑效率(详见BioArt报道:两篇Nat Med致CRISPR股票大跌,这回是因为p53)【1,2】;之后研究者还发现,CRISPR-Cas9还会在DSBs位点停留而导致大片段缺失乃至各种复杂的染色体结构异常(详见BioArt报道:NBT丨CRISPR编辑技术面临新的安全隐患——胡家志点评)【3】。以上研究关注的是Cas9蛋白与sgRNA同时存在时的安全风险,考虑到Cas9蛋白是一种外源性的核酸酶,其单独过表达对细胞和动植物等研究体系的影响值得进一步评估。2020年,研究者在人胚胎干细胞中发现,Cas9蛋白能直接结合DNA-PK复合物而干扰DNA修复通路(详见BioArt报道:特别关注丨 CRISPR-Cas9系统的新风险——破坏DNA-PK依赖的修复通路引发DNA损伤)【4】,这提示我们, Cas9蛋白本身便有潜在的安全风险。
2020年5月19日,来自Broad研究所和以色列特拉维夫大学的Uri Ben-David实验室在Nature Genetics杂志上发表了题为Cas9 activates the p53 pathway and selects for p53-inactivating mutations的论文。文章对Cas9蛋白本身的安全风险做了进一步评估。研究指出,在没有外源sgRNAs的条件下,Cas9蛋白过表达可激活多种细胞系中的p53通路并促进p53失活型突变的选择性富集。研究还发现,与p53失活的细胞系相比,Cas9在p53正常的细胞系中活性偏低;此外Cas9介导的p53活化会改变细胞对遗传/化学筛选的敏感性,从而影响筛选结果。

为系统性评估Cas9蛋白过表达的安全风险,研究者通过慢病毒感染的策略构建出165种Cas9过表达的稳转细胞系并对其基因表达谱进行分析。结果显示,与对照组相比,平均有87种基因的表达在Cas9细胞系中发生明显改变(表1)。基因富集分析(GSEA)指出,25种细胞系中Cas9过表达会显著激活p53通路及NF-κB通路,且这种对p53通路的激活主要发生于p53基因正常的细胞系中(TP53-WT细胞系)。之后研究者采用蛋白免疫印迹(western blot)法对Cas9过表达后p53及其下游靶基因p21的表达水平进行检测,结果表明,在五种TP53-WT细胞系中进行的八次实验中,七次实验均显示Cas9过表达会上调p53或p21蛋白的表达;而在四种p53失活型细胞系的四次实验中,Cas9过表达对p53或p21蛋白的表达无明显影响(表1)。此外,实时定量PCR实验进一步证实,TP53-WT细胞系中Cas9过表达会促进多种p53下游靶基因的表达。之后,研究者进一步排除了慢病毒感染、实验操作及筛选的瓶颈效应等可能导致p53通路活化的因素,从而证实了Cas9蛋白过表达是细胞系中p53通路活化的关键。
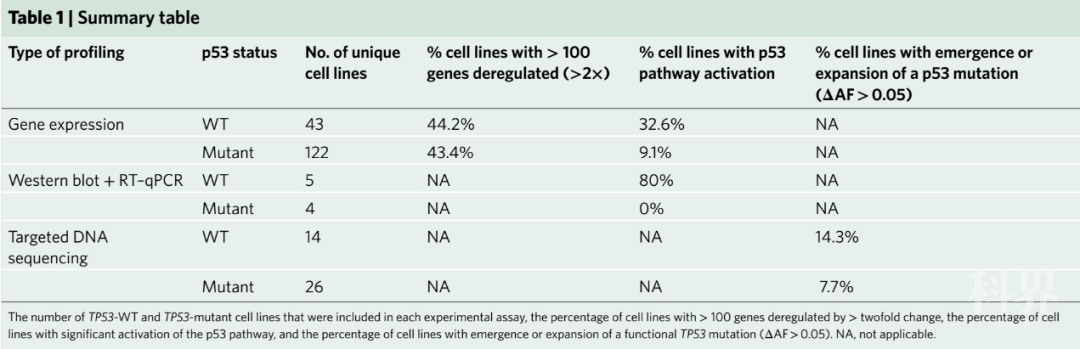
表1 Cas9过表达对各细胞系的影响
已知p53和NF-κB通路是DNA损伤转录响应的主要调控因子,这提示Cas9介导的p53活化或与DNA损伤有关。GSEA分析发现, 32/165种细胞系中Cas9过表达会导致DNA修复转录特征基因的显著富集;免疫荧光染色也证实,Cas9过表达会增加DNA双链断裂的风险。由此研究者推测,Cas9过表达导致DNA损伤风险增加或是p53通路活化的重要诱因,而p53活化很可能会限制细胞中Cas9蛋白的表达。因此,细胞要稳定表达Cas9很可能会导致p53失活型突变的选择性富集。为验证以上猜想,研究者对42种细胞系中447种癌基因的点突变特征进行系统分析后发现, Cas9过表达细胞系更易富集新的非同义突变。与相应的对照组相比,Cas9过表达细胞系平均富集4.5个癌基因相关的非沉默突变,这其中TP53基因在易突变癌基因中位居前列(前4%)。42种检测过的细胞系中,Cas9过表达导致细胞系JHH7中出现纯合的TP53非沉默突变,细胞系SNU1中出现TP53失活型突变;并导致另两种细胞系293T和HCC1419中携TP53失活型突变的亚克隆在增殖中占据明显优势从而呈现出选择性富集;此外,还有八种细胞系中的十种携TP53失活型突变的亚克隆在Cas9过表达后呈现出选择性富集。与此相对的是,三种对照组细胞系(空白对照组、报告基因或DNA条形码慢病毒感染组)中,并未有任何TP53非沉默突变的出现或选择性富集。研究者还发现,与其它抑癌基因相比,TP53非沉默突变亚克隆的选择性富集最为明显。HCT116细胞系中的细胞竞争实验也证实,Cas9过表达可特异性的促进携有TP53失活型突变细胞的增殖优势。此外研究者发现,TP53-WT细胞系中Cas9的活性明显低于其在TP53突变型细胞系中的活性。综上可知,p53确会限制Cas9的有效表达及活性,与之相对的是,Cas9过表达则促进p53失活型突变的选择性富集以保障自身的活性。
Cas9过表达对p53通路的激活会否影响并干扰CRISPR-Cas9为基础的筛选结果?研究者发现,与TP53突变型细胞系相比,TP53-WT细胞系中CRISPR-Cas9筛选结果与RNAi筛选结果的重合率明显降低。功能富集分析也发现,仅见于CRISPR-Cas9筛选结果的目的基因明显富集DNA复制与DNA损失修复以及RNA加工与病毒转录两大通路。研究者还指出,与其它细胞系相比,p53通路可被Cas9激活的细胞系中,CRISPR-Cas9介导的TP53基因敲除能更明显的促进细胞增殖。研究还发现,MCF7细胞系中,Cas9过表达能增加细胞对MDM2抑制剂的敏感性。这一系列结果均表明,细胞系中Cas9诱导的p53活化很可能会对遗传筛选和化学筛选的结果产生干扰。
总体而言,该研究通过一系列实验证实,在多种细胞系中Cas9蛋白本身可通过诱导DNA损伤而激活p53通路,并导致10%的细胞系中出现p53失活型突变的选择性富集。该研究提醒我们,在TP53-WT细胞系中过表达Cas9时须仔细监测p53的状态,且在应用CRISPR-Cas9技术时须对研究结果多加审视。目前我们对CRISPR-Cas9系统的安全风险及相关机制的认识仍有不足,因此需要更多研究为CRISPR-Cas9系统的未来应用奠定基础。
原文链接
https://doi.org/10.1038/s41588-020-0623-4
参考文献
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652485301&idx=5&sn=bac1fde4071f149a98f751a2ac4ef74e&chksm=84e22501b395ac173fc974005685395ad1e1da1f4589e9cbb540f63af9dc7a722761d120bd8f#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

让Crispr-Cas9基因编辑技术与类器官培养研究如虎添翼的利器
生物物理所等揭示anti-CRISPR沉默CRISPR-Cas9系统的分子机理

王艳丽组揭示anti-CRISPR沉默CRISPR-Cas9系统的分子机理

今日《细胞》:首个CRISPR-Cas9小分子抑制剂找到了!

《自然》子刊:一半癌症里都有它,今天我们终于有了新的抗癌策略

全基因组CRISPR-Cas9筛选确认癌症治疗优先考虑的靶点

Cell | 高通量筛选抑制CRISPR-Cas9的小分子药物

华人科学家报道CRISPR-Cas9治疗镰状细胞病进展
水生所在鱼类病毒的免疫逃逸机制研究中取得新进展

p53研究风云再起,顾伟团队发现p53诱导细胞铁死亡的必需基因和分子机制