科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-06-16
来源:BioArt
淀粉样蛋白纤维(amyloid fibrils)是一种常见的蛋白质聚集形式,被广泛认为与一些人类疾病紧密相关,如β淀粉样蛋白(amyloid-β, Aβ)与tau蛋白之于阿尔兹海默式症,以及人胰岛淀粉样多肽(human islet amyloid polypeptide, hIAPP)之于II型糖尿病【1】。胰岛淀粉样多肽是一个由胰岛细胞分泌的蛋白激素,与胰岛素共同参与血糖水平的调节【2】。人胰岛淀粉样多肽的纤维化聚集存在于超过90%的II型糖尿病病人的胰脏组织内,并且被认为在II型糖尿病的发病机制中起到了重要作用【3】。近期,基于冷冻电镜的螺旋重构技术成为解析淀粉样蛋白纤维的近原子分辨率结构的重要工具【4-6】。获取淀粉样蛋白纤维的分子结构信息可以帮助我们了解该蛋白聚集的分子机制,并且有助于设计抑制剂以消除或减缓该蛋白的聚集,从而推动对于相关疾病的发病机理以及治疗方法的研究。因此解析人胰岛淀粉样多肽的纤维结构可以极大地促进我们对II型糖尿病分子机制的理解以及对其治疗药物的研发。
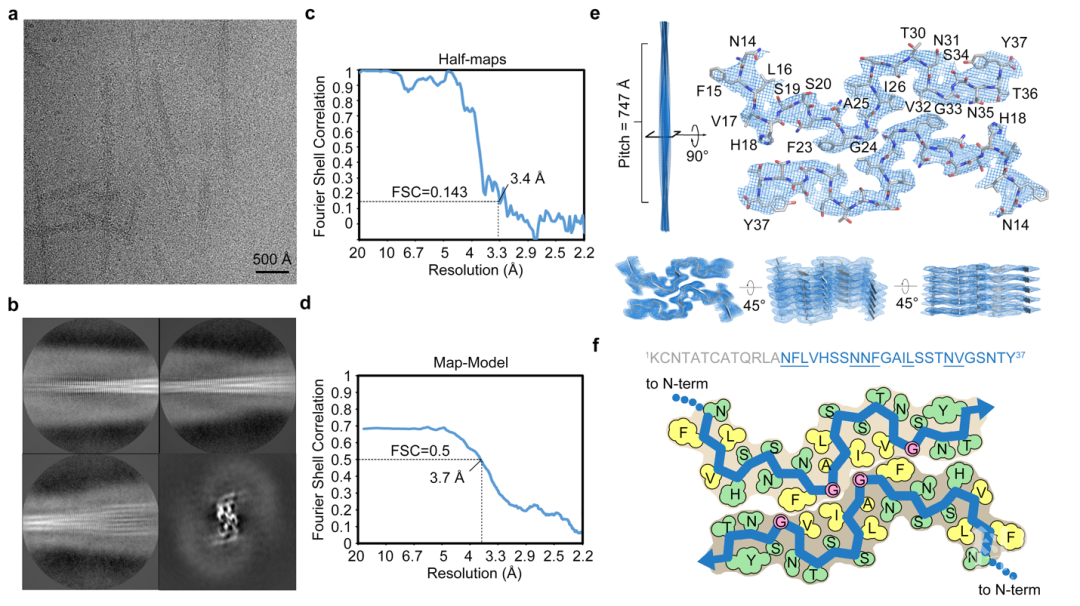 图1 全长人胰岛淀粉样多肽纤维的冷冻电镜结构
图1 全长人胰岛淀粉样多肽纤维的冷冻电镜结构 图2 人胰岛淀粉样多肽纤维结构的分析
图2 人胰岛淀粉样多肽纤维结构的分析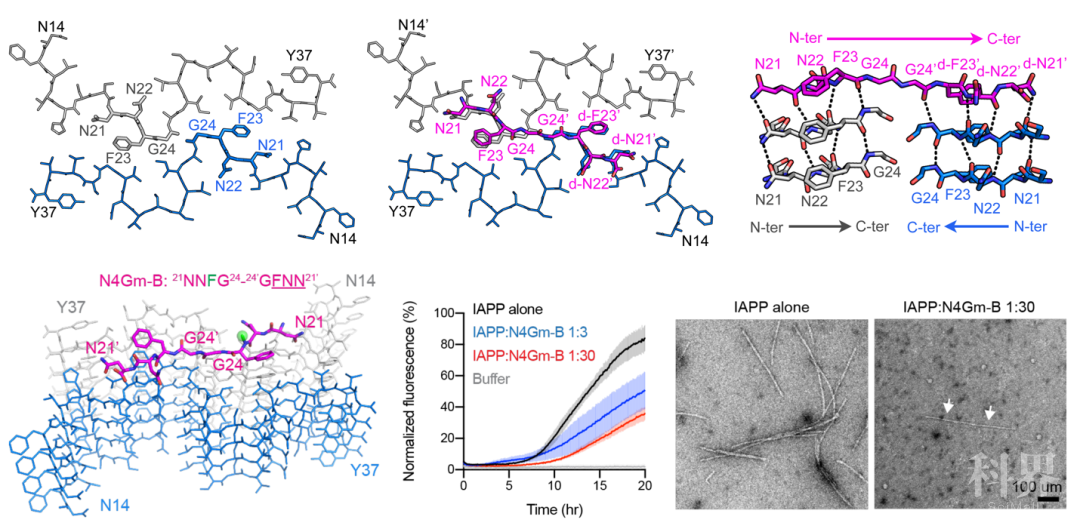 图3 基于人胰岛淀粉样多肽纤维结构的抑制剂设计
图3 基于人胰岛淀粉样多肽纤维结构的抑制剂设计来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652488178&idx=5&sn=0ea05d34ace92ae5ef19c9670cce964b&chksm=84e25246b395db50f6befbe3b00e3d4ae81e0b5f8d9eec183644b97f479c48fc64428900754b#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

联合国糖尿病日《中国综合临床》带你了解糖尿病
糖尿病性心脏病

中国研究型医院学会糖尿病与肥胖外科专业委员会在上海成立

中国疾控中心提示:糖尿病患者(糖尿病篇)

世界糖尿病日,盘点糖尿病领域重磅级研究成果!
中国疾控中心提示:糖尿病患者(糖尿病篇)




澳科学家开发出更有利肠道健康的小麦新品种

【糖尿病管理专题】糖尿病饮食控制的数字法则

每天6000步,竟走掉三大慢性病!关键要这样走

【健康科普】来势汹汹的糖尿病,要考虑1型糖尿病